1、选择题 下列微粒中:①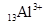 ?②
?②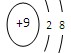 ?③
?③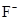 ,④
,④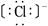 其核外电子数相同的是( )
其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
参考答案:A
本题解析:①②③④四种微粒核外电子数分别是10、10、10、18,选A。
本题难度:简单
2、选择题 下列说法中,正确的是
A.SO2和CO2分子中,S和O之间、C和O之间都是共价键
B.同一周期元素的原子半径越小越容易失去电子
C.碱金属元素是指第IA族的所有元素
D.P和As属于第VA族元素,H3PO4酸性比H3AsO4的弱
参考答案:A
本题解析:A 正确,都是分子晶体,S和O之间、C和O之间都是共价键
B 错误,同一周期元素的原子半径越小越容易得到电子
C 错误,氢元素除外
D 错误,H3PO4酸性比H3AsO4的强
本题难度:一般
3、选择题 下列物质属于混合物的是
A.液氯
B.蒸馏水
C.漂白粉
D.冰醋酸
参考答案:C
本题解析:分析:本题考查利用纯净物和混合物的概念来判断物质是否为纯净物,宏观上看只有一种物质,微观上只有一种分子为纯净物,否则为混合物.
解答:A、液氯是氯气的液体,是单质为纯净物,故A不符合;
B、蒸馏水是一种物质组成的属于纯净物,故B不符合;
C、漂白粉是氯气和氢氧化钙反应的生成产物为氯化钙和次氯酸钙的混合物,故C符合;
D、冰醋酸是固体醋酸为纯净物,故D不符合;
故选C.
点评:本题考查了纯净物、混合物概念的分析应用,在熟悉概念的基础上能从宏观和微观两个方面来判断纯净物和混合物,还要从社会实践中了解生活中常见物质的组成.
本题难度:困难
4、选择题 根据下表部分短周期元素的信息,判断相关叙述正确的是
元素代号?
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.089
| 0.102
| 0.074
|
主要化合价
| +2
| +3
| +2
| +6、-2
| -2
|
?
A.氢化物的稳定性:H2T<H2R
B.L的金属性比Q强
C.L与T形成的化合物属于离子化合物
D.L和M两者最高价氧化物对应的水化物能相互反应
参考答案:BC
本题解析:由于最低负价=主族序数—8,电子层数越多半径越大,则T、R分别是第VIA族的氧、硫,氧的非金属性比硫强,则气态氢化物的稳定性:H2O>H2S,故A错误;最高正价=主族序数,则L、Q分别是第IIA族的镁、铍,镁的金属性比铍强,故B正确;Mg是活泼金属,O是活泼非金属,二者形成的MgO是离子化合物,故C正确;M位于第IIIA族,原子半径比镁小,比铍大,说明它是铝,镁、铝的最高价氧化物对应的水化物分别是氢氧化镁,氢氧化铝,前者属于中强碱,后者属于两性氢氧化物,因此二者不能反应,故D错误。
本题难度:一般
5、选择题 下列叙述正确的是
A.同周期元素的原子半径以VIIA族的为最大
B.同主族元素两种元素原子的核外电子数的差值可能为26
C.短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属的分界线处找到了优良的催化剂
参考答案:B
本题解析:A、同周期元素的原子半径以IA族的为最大,错误;B、同主族元素两种元素原子的核外电子数的差值可能为26,第一、二主族的元素与其相隔一个周期的同族元素之间满足核外电子数的差值可能为26,正确;C、短周期元素中次外层电子数是最外层电子数2倍的原子不一定是非金属元素,如Li为金属元素,错误;D、科学家在周期表中金属与非金属的分界线处找到了优良的半导体材料,错误,答案选B。
本题难度:一般