1、选择题 下列说法不正确的是
A.蜡烛在氧气中燃烧是氧化还原反应,但不是化合反应
B.物质需要满足将温度升高到着火点以上和与氧气接触这两个条件才能燃烧
C.用氯酸钾制取氧气的反应是分解反应
D.凡是在通常状况下不能燃烧的物质,都是不能与氧气反应的物质
参考答案:D
本题解析:通常情况下不能燃烧的物质,例如铁,可以在纯氧中进行燃烧.
本题难度:一般
2、选择题 实验室用KClO3和浓盐酸反应制取氯气,化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O 若生成71g氯气,则被氧化的氯化氢
[?]
A.73g
B.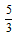 ×36.5g
×36.5g
C.3×36.5g
D.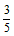 ×36.5g
×36.5g
参考答案:B
本题解析:
本题难度:一般
3、填空题 有硫酸、硫酸铜、硫酸铁的混合溶液100mL,已知溶液中各阳离子的物质的量浓度相等,硫酸根离子的浓度为6.0mol·L-1。
(1 )溶液中铜离子的物质的量为________ ,
(2 )此溶液理论上最多可溶解铁粉的质量 __________。
参考答案:(1 )0.2mol
(2 )铁粉的质量为22.4g
本题解析:
本题难度:一般
4、选择题 下列变化要加还原剂才能实现的是
A.CO32-→HCO3-
B.CuSO4→Cu
C.Mg→MgCl2
D.Cl2→HClO
参考答案:B
本题解析:
本题难度:一般
5、填空题 请利用氧化还原知识回答下列问题:
(1)铜和足量稀硝酸反应的离子方程式为______,反应中,稀硝酸的作用是______.当有l.2mol电子发生转移时,生成气体的体积(标准状况)______L.当有1mol气体(标准状况)生成,则被还原的HNO3的物质的量是______mol.
(2)在一定条件下,RO3n-和氯气发反应:RO3n-+Cl2+2OH-═RO42-+2Cl-+H2O由以上反应可知,在反应过程中RO3n-被______(填“氧化”或“还原”),RO3n-中元素R的化合价是______.
参考答案:(1)Cu与稀硝酸反应生成硝酸铜、NO和水,其离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,生成NO体现硝酸的氧化性,生成硝酸铜体现硝酸的酸性;反应中转移6mol电子时生成2molNO,被还原的硝酸为2mol,则有l.2mol电子发生转移时,生成NO体积为0.4mol×22.4L/mol=8.96L,1mol气体(标准状况)生成,则被还原的HNO3的物质的量是1mol(由N原子守恒也可知为1mol),故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;氧化性和酸性;8.96;1;
(2)RO3n-+Cl2+2OH-═RO42-+2Cl-+H2O,Cl元素的化合价降低,则R元素的化合价升高,则RO3n-被氧化,由电子守恒可知,[6-(6-n)]=1×2×[0-(-1)],解得n=2,RO3n-中元素R的化合价为x,则x+(-2)×3=-2,解得x=+4,故答案为:氧化;+4.
本题解析:
本题难度:一般