1、选择题 下列有关化学用语表示正确的是
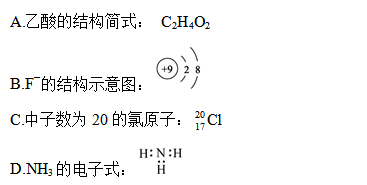
参考答案:B
本题解析:A中是分子式,不是结构简式;C中质量数错了;D中氨原子少电子;答案选B。
本题难度:一般
2、选择题 将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol?L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.生成沉淀完全时消耗NaOH溶液的体积为100mL
B.参加反应的硝酸的物质的量为0.1mol
C.开始加入合金的质量可能为16.4g
D.标况下产物NO的体积为22.4L
参考答案:将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,
沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,
则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为5.1g17g/mol=0.3mol,
根据电子转移守恒,则镁和铜的总的物质的量为0.3mol2=0.15mol,生成NO为0.3mol5-2=0.1mol,
A.加入的氢氧化钠恰好与硝酸镁、硝酸铜反应,由上述分析可知,加入的NaOH为0.3mol,故加入NaO溶液的体积为0.3mol3mol/L=0.1L=100mL,故A正确;
B.根据方程式可知参加反应的n反应(HNO3)=83n(金属)=83×0.15mol=0.4mol,故B错误;
C.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故C错误;
D.标况下NO的体积为0.1mol×22.4L/mol=2.24L,故D错误,
故选:A.
本题解析:
本题难度:简单
3、简答题 向20mLAlCl3溶液中滴入2mol/LNaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义是______.
(2)图中B点表示的意义是______.
(3)若溶液中有Al(OH)3沉淀0.39g,此时用去NaOH溶液体积为______.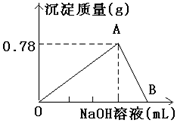
参考答案:(1)由图象可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,故答案为:Al3+完全沉淀;
(2)由图象可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解,故答案为:Al(OH)3刚好完全溶解;
(3)溶液中有Al(OH)3沉淀0.39g,n=0.39g78g/mol=0.005mol,存在两种情况,则
①只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,设此时用去NaOH溶液体积为x,则
0.005mol×32mol/L=0.0075L=7.5mL,
②若发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,则
0.01mol×3+0.005mol2mol/L=0.0175L=17.5mL,
故答案为:7.5mL或17.5mL.
本题解析:
本题难度:一般
4、选择题 下列有关化学用语错误的是(?)
A.硫离子的核外电子排布式:1s22s22p6
B.碳原子的外围电子轨道表示式: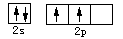
C.碳-14原子:14 6C
D.Cl-的结构示意图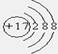
参考答案:A
本题解析:硫离子核外有18个电子,核外电子排布式正确的应该是:1s22s22p63s23p6。
点评:对于常见的化学用语,要能规范、正确使用。
本题难度:一般
5、选择题 下列反应中必须加入氧化剂才能进行的是(?)
A.Zn2+→Zn
B.H2 → H2O
C.CaO → Ca(OH)2
D.CuO → Cu
参考答案:B
本题解析:考查氧化还原反应的概念
加入氧化剂才能进行,也就是说选项中物质的元素应该被氧化,元素化合价应该升高,故只有B项符合题意,其中的氢元素由0价升至+1价
本题难度:简单