|
高中化学必备知识点《盐类水解的原理》答题技巧(2017年最新版)(十)
2018-03-17 08:04:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 0.1 mol?L-1 KHS溶液中下列表达式不正确的是
A.c(K +)+c(H+)=" c(OH-)+" c(HS-)+2 c(S2-)
B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol?L-1
D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
参考答案:B
本题解析:KHS溶液中,水解程度大于电离程度,所以溶液显碱性,因此c(K+)> c(HS-)> c(OH-)> c(H+)> c(S2-),B不正确,D正确。A符合电荷守恒,C中符合物料守恒,均正确。答案选B。
本题难度:简单
2、选择题 25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1 L 0.1 mol·L-1 (NH4)2Fe(SO4)2·6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-)
B.0.1 mol·L-1的NH4Cl与0.1 mol·L-1的NH3·H2O等体积混合:c(NH4+)+2c(H+)=c(NH3·H2O)+2c(OH-)
C.pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-)
D.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
|
参考答案:BD
本题解析:根据电荷守恒可以判断A错误;根据电荷守恒和物料守恒可知B正确;pH=9.4说明水解大于电离,所以c(HCN) 的浓度大于c(CN-)故C错误;0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后溶液中有CH3COOH为0.025mol·L-1、CH3COONa为0.025mol·L-1所以有c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)故D正确。
考点:溶液中微粒的浓度的大小比较
本题难度:困难
3、填空题 计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是 。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因: 。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液 中c(H+)约为 mol/L。(已知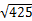 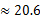 ) )
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是 。
②在KHC2O4溶液中,各粒子浓度关系正确的是 。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)
参考答案:(1)AD (2)Xn- + H2O 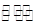 HX(n-1)- + OH- (3)0.078 (4)? HX(n-1)- + OH- (3)0.078 (4)?
c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) ?CD
本题解析:
试题解析:(1)弱电解质的电离为吸热过程,升温促进电离,则比值增大,故A正确;加少量固态HnX,HnX浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故B错误;加入NaOH溶液,消耗氢离子,使c(H+)减小,则比值减小,故C错误;加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡向正向移动,氢离子浓度减的少,HnX浓度减得大,比值增大,故D正确。(2)HnX是弱酸,Xn-在水溶液中存在水解平衡:Xn- + H2O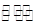 HX(n-1)- + OH-,故NanX溶液呈碱性;(3)K1= HX(n-1)- + OH-,故NanX溶液呈碱性;(3)K1= =5×10-2、K2= =5×10-2、K2=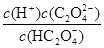 =5×10-5,解得,c(H+)=0.078mol/L;(4)?KHC2O4溶液呈酸性,说明草酸氢根离子的电离程度大于其水解程度,所以溶液显酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);? HC2O4-电离程度大于水解程度,c(C2O42-)>c(H2C2O4),故A错误;在KHC2O4溶液中,电荷守恒关系式为c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒关系式为c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4),故C、D正确;由电荷守恒关系式和物料守恒关系式c(C2O42-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B错误。 =5×10-5,解得,c(H+)=0.078mol/L;(4)?KHC2O4溶液呈酸性,说明草酸氢根离子的电离程度大于其水解程度,所以溶液显酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);? HC2O4-电离程度大于水解程度,c(C2O42-)>c(H2C2O4),故A错误;在KHC2O4溶液中,电荷守恒关系式为c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒关系式为c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4),故C、D正确;由电荷守恒关系式和物料守恒关系式c(C2O42-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B错误。
考点:弱电解质的电离
本题难度:一般
4、选择题 向20 mL 0.1 mol·L-1氨水中逐滴加入0.1mol·L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示。下列说法正确的是
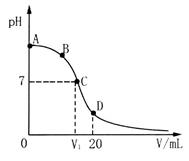
A.在D点:c(NH4+)+c(NH3·H2O)>c(Cl-)
B.在C点,有V1>10,且c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.由B到C的过程中,c(NH4+)/c(NH3·H2O)先增大后减小
参考答案:B
本题解析:A、在D点,对应20mL的稀盐酸与氨水恰好完全反应,溶质只有NH4Cl,根据物料守恒c(NH4+)+c(NH3·H2O)=c(Cl-),错误;B、恰好完全反应时,溶质是NH4Cl,其属于强酸弱碱盐,水溶液显酸性,V1=10mL,此时溶液中溶质是NH4Cl、NH3·H2O,NH3·H2O的电离大于NH4+的水解溶液显碱性,因此pH=7,V1>10,根据溶液呈现电中性,c(NH4+)+c(H+)=c(Cl-)+c(OH-),pH=7则c(OH-)=c(H+),有c(NH4+)=c(Cl-),c(NH4+)=c(Cl-)>c(OH-)=c(H+),正确;C、在A、C间任一点,有可能只加入很少量的稀盐酸,此时溶液中离子浓度:c(NH4+)>c(OH-)>c(Cl-)>c(H+),错误;D、由B到C的过程中,不断生成NH4+,NH3·H2O不断消耗,因此c(NH4+)/c(NH3·H2O)一直增大,错误。
考点:考查离子浓度大小的比较、物料守恒、电荷守恒等相关知识。
本题难度:困难
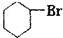
5、选择题 能在KOH的醇溶液中发生消去反应的是( )
A.CH3Cl
B.(CH3)3CCH2Cl
C.
D.
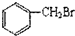
参考答案:C
本题解析:
本题难度:一般
|