1、选择题 已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11。下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
参考答案:B
本题解析:A错,Mg(OH)2与MgF2均属于AB2型,由于Ksp〔Mg(OH)2〕<Ksp〔MgF2〕,所以25°C时,饱和Mg(OH)2溶液与饱和Mg来源:91考试网F2溶液相比,前者的c(Mg2+)小;B正确,加入NH4Cl固体后,溶液中NH4+能与溶液中的OH—结合成弱电解质NH3·H2O,促使Mg(OH)2的溶解度增大,溶液中的c(Mg2+)增大;C错,Ksp只受温度影响与其他因素无关;D错,25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,只要溶液中的F—浓度足够大,Mg(OH)2可能转化为MgF2
本题难度:一般
2、选择题 向5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液生成沉淀,则生成沉淀后溶液中Ag+的物质的量浓度为(已知?Ksp(AgCl)=1.8×10-10)( )
A.不存在
B.1.8×10-6mol/L
C.1.8×10-7mol/L
D.1.8×10-8mol/L
参考答案:5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液加入后两者浓度分别为
c(Ag+)=0.182=0.09 (mol/L)
c(Cl-)=0.22=0.1 (mol/L)
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.1-0.09=0.01(mol/L)
已知:C(Ag+)×C(Cl-)=1.8×10-10,
则:C(Ag+)=1.8×10-100.01=1.8×10-8(mol/L)
故选D.
本题解析:
本题难度:一般
3、选择题 一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(S) Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少
B.溶液c(Ca2+)减小
C.溶液的C(OH-)增大
D.溶液中溶质的质量分数增大
参考答案:A
本题解析:生石灰溶于水,和水生成氢氧化钙。由于溶液是饱和溶液,属于生成的氢氧化钙不能溶解。又因为溶剂减少,则原溶液中的氢氧化钙也会析出,但温度不变,溶液仍然是饱和溶液,所以选项A正确,其余都是错误的,答案选A。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的答题效率。
本题难度:一般
4、选择题 下列说法中不正确的是(?)
A.Ksp只与难溶电解质本身的性质和温度有关
B.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数
C.在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大
D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀
参考答案:C
本题解析:Ksp只与难溶电解质本身的性质和温度有关,所以A正确,在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数,所以B也正确;在一定温度下,向AgCl饱和溶液中加入盐酸时,由于温度不变,所以Ksp值不变,所以C不正确,为本题的正确答案;由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀,故D正确。
点评:本题考查了溶解度,溶解度常数,考生要注意温度不变,物质的溶解度常数不变,本题比较容易。注意本题是选择说法不正确的。
本题难度:一般
5、计算题 硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入 6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的体积为 200mL,计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL0.0268 mol/LBaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少L 0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L
参考答案:(1)0.0536 mol/L? (2)0.0536 mol/L? (3)0.489L
本题解析:(1)25℃时,Ag2SO4的溶解度为0.836g,故200g水在25℃最多可溶解Ag2SO42×0.836=1.672g,即烧杯中加入6.24gAg2SO4实
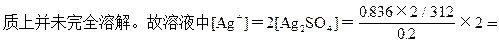
0.0536mol/L。
(2)在烧杯中加入50mL,0.0268 mol/L BaCl2溶液后,由于发生反应:Ag2SO4+BaCl2=BaSO4↓+2AgCl↓,消耗了溶液中的Ag+和SO42-,使未溶解的Ag2SO4固体继续溶解。消耗的Ag2SO4质量为0.05×0.0268
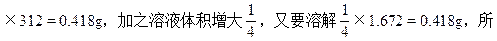
以共又溶解了0.418+0.418=0.836<6.24-1.672。即溶液仍为饱和溶液,所以溶液中[Ag+]=0.0536mol/L。
(2)假设烧杯中6.24g Ag2SO4被刚好溶解完,则溶液中Ag2SO4的物
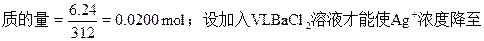
0.0200mol/L即Ag2SO4的浓度降至0.0100mol/L;
根据? Ag2SO4+BaCl2=2AgCl↓+BaSO4↓
0.0268V? 0.0268V
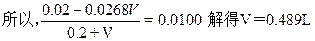
本题难度:一般