1、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。

回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol/L。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=_________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol/L,c(ASO43-)最大为___________mol/L
(3)工厂排放出的酸性废水中的三价砷(H3ASO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷
(H3AsO4弱酸),写出该反应的离子方程式:__________________。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______________。
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为___________。
参考答案:(1)0. 29
(2)c3(Ca2+)·c2(AsO43-);5.7×10-17
(3)2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
(4)①CaSO4;②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO42-浓度增大,Ca3(AsO4)2开始沉淀
本题解析:
本题难度:一般
2、选择题 相同条件下,BaSO4在等浓度的下列溶液中溶解度最小的是( )
A.NaCl
B.HNO3
C.CuSO4
D.NaOH
参考答案:硫酸钡在相同条件下在溶液中存在沉淀溶解判断,平衡为BaSO4(s)?Ba2++SO42-;饱和溶液中溶度积是常数,Ksp=[Ba2+]×[SO42-];
A、NaCl溶液中对硫酸钡溶解度无影响,故A不符合;
B、HNO3溶液中离子对沉淀溶解平衡不影响,故B不符合;
C、CuSO4溶液中Cu2+对沉淀溶解平衡起到抑制作用,硫酸钡溶解性减小,故C符合;
D、NaOH溶液对沉淀溶解平衡无影响,故D错误;
故选C.
本题解析:
本题难度:简单
3、简答题 向盛有1mL0.1mol/LMgCl2溶液的试管中滴加1~2滴2mol/LNaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是______.再滴加2滴0.1mol/LFeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是______.由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是______.
参考答案:向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,MgCl2与NaOH反应生成氢氧化镁沉淀,其反应的离子方程式为:Mg2++2OH-═Mg(OH)2↓;再滴加2滴0.1mol/L FeCl3溶液,Mg(OH)2沉淀转化为溶解度更小的Fe(OH)3沉淀,其反应的离子方程式为3Mg(OH)2+2Fe3+?3Mg2++2Fe(OH)3,根据沉淀转化原理:溶解度小的物质转化为溶解度更小的容易实现,所以相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是Mg(OH)2,
故答案为:Mg2++2OH-═Mg(OH)2↓;3Mg(OH)2+2Fe3+?3Mg2++2Fe(OH)3;Mg(OH)2.
本题解析:
本题难度:一般
4、选择题 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
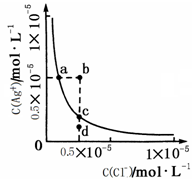
A.加入NaCl可以使溶液由a点变到b点
B.向AgCl饱和溶液中加入水, C(Ag+)增大
C.d点无AgCl沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:,AgCl在水中的沉淀溶解平衡方程式为: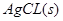 ?
?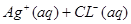 ,所以
,所以
A错,加入NaCl,溶液中氯离子浓度增大,沉淀溶解平衡向逆反应方向移动,溶液中的银离子浓度减小;B错,饱和溶液中加入水,此时仍然是饱和溶液,溶液中各离子浓度不变;C正确;溶液中浓度积小于溶度积,处于不饱和状态;D错,溶度积受温度影响与其他因素无关;
本题难度:一般
5、选择题 在一定温度下,氯化银在水中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
A.①>②>④>③
B.②>①>④>③
C.④>③>②>①
D.①>④>③>②
参考答案:A
本题解析:加入的氯离子浓度越大,平衡逆向移动,银离子浓度越小。故有答案A。
本题难度:一般