1、填空题 (12分)实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
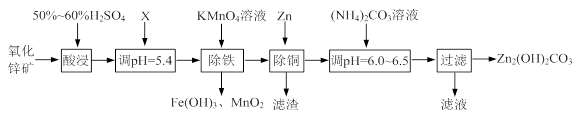
(1)“酸浸”时保持H2SO4过量的目的是 。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式: 。
②流程中调节pH=5.4所加试剂X为 (填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由 。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。

参考答案:(1)提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解)(答1点即给分)
(2)①3Fe2+ + MnO4-+7H2O=3Fe(OH)3↓ + MnO2 ↓+5H+(不配平扣1分)
②ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等均给分)
不能,(1分)强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀(1分)
(3)(NH4)2SO4(多答碳酸氢铵等视而不见)
(4)Zn2(OH)2CO3 + 2H2S=2ZnS↓+CO2↑+3H2O(不配平扣1分)
本题解析:(1)“酸浸”时,硫酸与ZnO、FeCO3、CuO反应,生成硫酸盐等,溶液中存在金属阳离子,均会发生水解反应,所以酸浸时硫酸过量的目的是提高矿石的浸出率,防止Zn2+、Fe2+、Cu2+等金属离子水解;
(2)①由流程图可知,加入高锰酸钾除铁时,Fe元素以氢氧化铁的形式除去,同时生成二氧化锰,所以加入KMnO4溶液除铁的离子方程式是3Fe2+ + MnO4-+7H2O=3Fe(OH)3↓ + MnO2 ↓+5H+;
②最终的产物是碱式碳酸锌流程中调节pH=5.4所加试剂X既能除去过量的硫酸调节溶液的pH又不能引入新的杂质,所以X只能是ZnO或碱式碳酸锌、碳酸锌、氢氧化锌等;
试剂X与高锰酸钾不能互换,因为在酸性条件下,高锰酸根离子被还原为锰离子,而锰离子沉淀时的pH=8.1>5.4,此时Zn2+也会沉淀,所以不能互换;
(3)由流程图可知,除铜后的溶液中的溶质为硫酸锌,加入碳酸铵后,主要得到碱式碳酸锌和硫酸铵,硫酸铵可做化肥,所以滤液中的溶质是(NH4)2SO4;
(4)碱式碳酸锌吸收硫化氢后得到ZnS沉淀,同时又二氧化碳、水生成,过滤后可达到除硫的目的,所以碱式碳酸锌吸收硫化氢的化学方程式为Zn2(OH)2CO3 + 2H2S=2ZnS↓+CO2↑+3H2O。
考点:考查对工业流程的分析,物质性质的判断
本题难度:困难
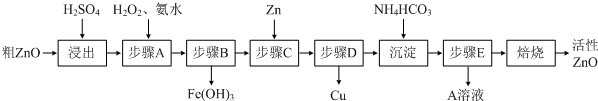
2、填空题 活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+
开始沉淀时pH
6.34
1.48
6.2
5.2
完全沉淀时pH
9.7
3.2
8.0
6.4
|
请问答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是______,该步骤需控制溶液pH的范围是______.
(2)A溶液中主要含有的溶质是______.
(3)若经处理后的废水pH=8,此时Zn2+的浓度为______mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17).
(4)步骤C中加Zn的目的是______.
参考答案:(1)步骤A加入H2O2的目的是将Fe2+氧化为Fe3+ 便于除去,同时不引入新的杂质,反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O,由流程图看出该步操作只生成Fe(OH)3沉淀,结合表中数据可知需控制溶液pH为3.2-5.2之间,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;3.2~5.2;
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵,过滤后,得到的滤液溶质主要为(NH4)2SO4,
故答案为:(NH4)2SO4;
(3)由c(Zn2+)×c2(OH-)=1.27×10-17
c(Zn2+)=1.2×10-17(10-6)2mol/L=1.2×10-5mol/L,
即1.2×10-5mol?L-1×65g?mol-1=7.8×10-4g/L=0.78mg/L,
故答案为:0.78;
(4)Zn比Cu活泼,可将将Cu2+还原为Cu从而除去Cu2+,故答案为:将Cu2+还原为Cu从而除去Cu2+.
本题解析:
本题难度:一般
3、选择题 下列有关AgCl沉淀的溶解平衡说法正确的是
A.AgCl溶液中,c(Cl—)×c(Ag+)是一个定值
B.AgCl难溶于水,溶液中没有Ag+和Cl—
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,沉淀的溶解度不变