1、选择题 具有下列条件的微粒中,其元素的非金属性最强的是( )
A.原子结构示意图为

B.离子结构示意图为

C.原子质量数为24,中子数为12
D.元素正、负化合价绝对值相同
参考答案:A.原子结构示意图为

的元素为Li;
B.离子结构示意图为

的元素为F;
C.原子质量数为24,中子数为12,则质子数为24-12=12,为Mg元素;
D.元素正、负化合价绝对值相同的元素为C或Si,
以上四种元素中,非金属性最强的元素为F,
故选B.
本题解析:
本题难度:一般
2、填空题 有位于20号元素前,原子序数依次递增的A、B、C、D、E五种元素.A、C元素的电子层数相同;A、E两元素的最外层和次外层电子数相同;A和C可形成化合物AC,D和E可形成ED2;B元素的原子最外层即M层有3个电子.
(1)试写出这五种元素的名称和符号:A______、B______、C______、D______、E______;
(2)写出下列反应的化学方程式①A+C→AC______.②D+E→ED2______.
参考答案:由A,C两元素原子的电子层数相同,所以A,C同周期,又A,B,C,D,E五种元素原子序数依次递增,所以B与A,C是同周期的.由“A,E两元素原子的最外层和次外层电子数分别相同”,可知A在第三周期,E在第四周期.所以B在第三周期,且B元素原子的最外层只有3个电子,所以B是Al.所以A只能为钠或镁,当A是钠时,因为A,C形成化合物AC,所以此时C为氯,则E为钾,而D只能是氩,但“D,E形成化合物E2D”,所以D不可能是氩,所以A只能是镁,C是硫,E是钙,D是氯.
(1)A、B、C、D、E五种元素的名称和符号分别为:镁 Mg、铝 Al、硫 S、氯 Cl、钙 Ca,故答案为:镁 Mg;铝 Al;硫 S;氯 Cl;钙 Ca;
(2)镁和硫反应的方程式为:Mg+S?△?.?MgS,钙和氯气反应方程式:Ca+Cl2?点燃?.?CaCl2,故答案为:Mg+S?△?.?MgS;?Ca+Cl2?点燃?.?CaCl2.
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E、F均为短周期元素,原子序数依次增大,A元素原子核内无中子.B元素原子核外最外层电子数是次外层电子数的2倍.C元素是地壳中含量最多的元素.D是短周期元素中金属性最强的元素.E与D元素的质子数之和为27,最外层电子数之差为5.F元素的最高价氧化物的水化物为强酸.
(1)推断B元素在周期表中的位置:第______周期______族.
(2)写出F元素的电子排布式:______.
(3)C、D元素可形成淡黄色的粉末,其电子式为______,所含化学键为______.
(4)写出A与C元素形成10电子的微粒:______、______、______.
(5)D、E元素形成的正盐的水溶液,阴离子的浓度大小顺序为:(从大到小排列)______.
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量.写出反应的热化学方程式:______.
参考答案:A、B、C、D、E、F均为短周期元素,原子序数依次增大.A元素原子核内无中子,则A为氢元素.B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素.C元素是地壳中含量最多的元素,则C为氧元素.D是短周期元素中金属性最强的元素,则D为钠元素.E与D元素的质子数之和为27,则E元素的质子数为27-11=16,则E为硫元素.F元素的最高价氧化物的水化物为强酸,原子序数比硫大,则F为氯元素.
即A为氢元素、B为碳元素、C为氧元素、D为钠元素、E为硫元素、F为氯元素.
(1)B为碳元素,原子核外有2个电子层,最外层有4个电子,位于周期表第二周期第ⅣA族.
故答案为:二;ⅣA.
(2)F为氯元素,原子核外有17个电子,电子排布式为1s22s22p63s23p5.
故答案为:1s22s22p63s23p5.
(3)C为氧元素、D为钠元素,二者形成的淡黄色物质为Na2O2,Na2O2是离子化合物,由钠离子与过氧根离子构成,
电子式为
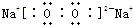
.钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成1对共用电子对,是非极性共价键.
故答案为:
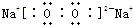
;离子键、非极性共价键.
(4)A为氢元素、C为氧元素,氢元素与氧元素形成10电子的微粒有H2O、H3+O、OH-.
故答案为:H2O、H3+O、OH-.
(5)D为钠元素、E为硫元素,二者形成的正盐为Na2S,属于强碱弱酸盐,所以Na2S的水溶液中,S2-水解S2-+H2O?HS-+OH-,由于水解程度不大,所以离子浓度c(S2-)>c(HS-),由于溶液中存在水的电离,所以c(OH-)>c(HS-),水的电离程度不大,所以c(S2-)>c(HS-),所以阴离子的浓度大小顺序为c(S2-)>c(OH-)>c(HS-).
故答案为:c(S2-)>c(OH-)>c(HS-).
(6)A为氢元素,C为氧元素,常温下,1mol氢气与氧气化合生成液态水,放出286kJ的热量,反应的热化学方程式为H2(g)+12O2(g)=H2O(l);△H=-286kJ/mol.
故答案为:H2(g)+12O2(g)=H2O(l);△H=-286kJ/mol.
本题解析:
本题难度:一般
4、选择题 现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素.下列说法不正确的是( )
A.原子半径:Y<Q<W
B.ZX3可使紫色石蕊溶液变蓝
C.X、Z、Q?3种元素可组成离子化合物或共价化合物
D.X2Q2、Y2X62种分子中含有的电子数、化学键种类都相同
参考答案:X是周期表中原子半径最小的元素,应为H元素,X和W同主族,则W是Na或Li元素,Y元素原子核外电子总数是其次外层电子数的3倍,所以Y是C元素;W的原子序数大于Y,所以W是Na元素;Q元素是地壳中含量最高的元素,为O元素,Z的原子序数大于Y而小于Q,所以Z是N元素.
A.C和O属于同一周期,碳原子半径大于氧原子半径,碳原子半径小于钠原子半径,所以原子半径:Q<Y<W,故A错误;
B.氨气溶于水得到氨水,氨水电离出氢氧根离子而使溶液呈碱性,所以氨气可使紫色石蕊溶液变蓝,故B正确;
C.铵盐属于离子化合物,硝酸是共价化合物,故C正确;
D.H2O2、C2H62种分子中含有的电子数都是18,化学键种类都是共价键,故D正确;
故选A.
本题解析:
本题难度:简单
5、选择题 X、Y、Z三种元素原子具有相同的电子层数,x的最高价氧化物对应水化物呈碱性,Y的最高价氧化物对应水化物呈酸性,而z的最高价氧化物对应水化物呈两性,则它们的原子序数逐渐增加的顺序是( )
A.X、Y、Z
B.X、Z、Y
C.Z、Y、X
D.Y、Z、X
参考答案:X、Y、Z三种元素原子具有相同的电子层数,则三元素处于同一周期,x的最高价氧化物对应水化物呈碱性,Y的最高价氧化物对应水化物呈酸性,而z的最高价氧化物对应水化物呈两性,则X为金属,Y为非金属,Z即具有金属性与具有非金属性,同一周期随原子序数增大,金属性减弱,非金属性增强.所以原子序数X<Z<Y.
故选:B.
本题解析:
本题难度:一般