1、填空题 (14分)铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)? ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s)? ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
温度
| 300
| 727
| 1227
|
lgK
| 6.17
| 2.87
| 1.24
|
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为?。
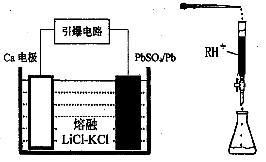
(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为。
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。
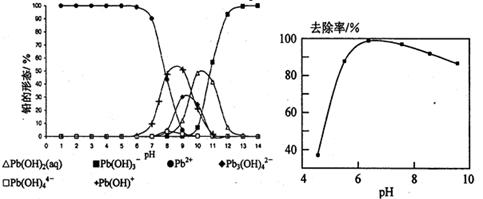
①常温下,pH=11→13时,铅形态间转化的离子方程式为。
②用活性炭处理,铅的去除率较高时,铅主要应该处于(填铅的一种形态的化学式)形态。
参考答案:(1)2a+2b-3c?
(2)①<;? ②9.09%
(3)PbSO4 + 2e-= SO42-+ Pb(或PbSO4 +Ca2++ 2e-= CaSO4+ Pb)
(4)4×10-9
(5)①Pb(OH)2 + OH- ?Pb(OH)3-? ②Pb2+
?Pb(OH)3-? ②Pb2+
本题解析:(1 )依据盖斯定律,将前两式分别乘2,减去最后一式乘3,即可得所求反应的?H。(2)①lgK与K为增函数关系,从表中数据知,温度越高,K越小,说明正反应放热。②lgK=1,得K=10。设开始时通入CO为amol/L,达平衡时转化了x mol/L,则平衡时,CO为(x-a)mol/L,CO2为x mol/L,由K=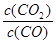 =
=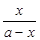 =10,解得
=10,解得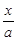 =9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3 mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)= C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)= 10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由11变到13时,是Pb(OH)2向Pb(OH)3-转化,结合一个OH-。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
=9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3 mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)= C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)= 10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由11变到13时,是Pb(OH)2向Pb(OH)3-转化,结合一个OH-。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
本题难度:一般
2、选择题 用NH3制取硝酸的第一步反应为:4NH3+5O2 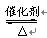 4NO+6H2O。对该反应的有关说法错误的是
4NO+6H2O。对该反应的有关说法错误的是
A.该反应是可逆反应
B.反应中NH3能全部转化为NO
C.催化剂能加快该反应的速率
D.升高温度能加快该反应的速率
参考答案:B
本题解析:略
本题难度:一般
3、简答题 (1)体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率______,充分反应后产生氢气的量______(相同、醋酸的多、盐酸的多),原因是______.
(2)在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入______晶体,理由是______;要使产生氢气的量不变,但反应速率减慢,可加入______晶体,理由是______.
可供选择的晶体有:
A.纯碱?B.烧碱?C.胆矾?D.醋酸钠?E.KHSO4.
参考答案:(1)开始时c(H+)相同,浓度的大小决定反应速率的大小,则反应速率相同,醋酸为弱酸,不能完全电离,体积相同,c(H+)相同的盐酸和醋酸溶液中醋酸的物质的量大于盐酸的物质的量,所以醋酸反应放出的气体多,
故答案为:相等;醋酸的多;当c(H+)相同时,反应开始时的速率相同,c(H+)相同时,醋酸物质的量浓度大,含溶质物质的量多,所以反应放出的氢气多;
(2)A、纯碱和盐酸反应,会消耗盐酸,减少生成氢气的总量;
B、烧碱和盐酸反应,会消耗盐酸,减少生成氢气的总量;
C、胆矾和锌反应生成单质铜,形成原电池反应,加快反应速率,但不影响生成氢气的总量;
D、醋酸钠和盐酸反应生成醋酸,醋酸为弱酸,溶液中氢离子浓度减小,反应速率减小,但不影响生成氢气的总量;
E、KHSO4增大溶液中氢离子浓度,使生成氢气的总量增加.
所以:在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入胆矾,胆矾和锌反应生成单质铜,形成原电池反应,加快反应速率;
要使产生氢气的量不变,但反应速率减慢,可加入醋酸钠,醋酸钠和盐酸反应生成醋酸,醋酸为弱酸,溶液中氢离子浓度减小,反应速率减小,但不影响生成氢气的总量.
故答案为:C;Zn置换出Cu附在Zn表面构成原电池,使反应速率加快,但由于溶液中H+的量不变,因此产生氢气的量不变;
D;CH3COO-与H+结合成弱电解质CH3COOH;致使溶液中c(H+)降低,使反应速率变慢,而溶液中可提供的H+的数量不变,所以放出的氢气的量不变.
本题解析:
本题难度:一般
4、选择题 对于可逆反应:2A(g)+B(g) 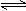 2C(g); △H<0,下列各图正确的是
2C(g); △H<0,下列各图正确的是

A B C D
参考答案:A
本题解析:略
本题难度:一般
5、选择题 mA(s)+nB(g) qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图所示,有关叙述正确的是( )。
qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图所示,有关叙述正确的是( )。
A.n<q
B.n>q
C.X点,v正>v逆;Y点,v正<v逆
D.X点比Y点反应速率快