1、填空题 离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填编号)。
①单质?②氧化物?③电解质?④盐?⑤化合物
(2)一种无色透明溶液中,可能含有下列离子: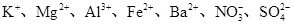 、
、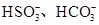 、I-和Cl-,取该溶液进行如下实验:
、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀硝酸的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______;不能作出判断的离子是_______。
参考答案:(1)③⑤? (2)Fe2+、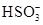 、
、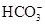 、I-、Ba2+
、I-、Ba2+
Mg2+、Al3+、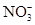 、
、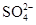 ? K+、Cl-
? K+、Cl-
本题解析:(1)有离子参与或生成的反应是离子反应,只要有离子,就必有电解质,而电解质属于化合物。
(2)由无色溶液知,溶液中一定不存在Fe2+;由实验①知,溶液呈酸性,则Mg2+、Al3+、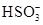 中至少存在一种;由实验②知,溶液中一定存在
中至少存在一种;由实验②知,溶液中一定存在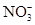 ;由实验③知,溶液中一定存在
;由实验③知,溶液中一定存在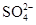 ,则溶液中一定不存在Ba2+;由于实验③中已经引入Cl-,所以由实验④无法确定Cl-的存在;由实验⑤知,产生的白色沉淀部分溶解,则溶液中一定存在Mg2+和Al3+,则溶液中一定不存在
,则溶液中一定不存在Ba2+;由于实验③中已经引入Cl-,所以由实验④无法确定Cl-的存在;由实验⑤知,产生的白色沉淀部分溶解,则溶液中一定存在Mg2+和Al3+,则溶液中一定不存在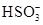 和
和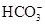 ?(水解相互促进反应);由于溶液呈酸性,且存在
?(水解相互促进反应);由于溶液呈酸性,且存在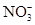 ,所以溶液中一定不存在I-。综合分析:溶液中肯定不存在的离子是:Fe2+、
,所以溶液中一定不存在I-。综合分析:溶液中肯定不存在的离子是:Fe2+、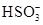 、
、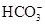 、I-、Ba2+,溶液中肯定存在的离子是:Mg2+、Al3+、
、I-、Ba2+,溶液中肯定存在的离子是:Mg2+、Al3+、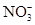 、
、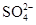 ,溶液中无法确定的离子是:K+、Cl-
,溶液中无法确定的离子是:K+、Cl-
本题难度:一般
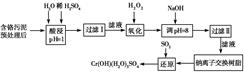
2、填空题 某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。
氢氧化物
| Fe(OH)3
| Mg(OH)2
| Al(OH)3
| Cr(OH)3
|
pH
| 3.7
| 11.1
| 8
| 9(>9溶液)
|
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:
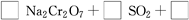
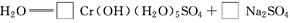 ;
;
生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
参考答案:(1)①升高温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(只要答出任意一点即可,其他合理答案也可) (2)Fe3+和Al3+
(3)Mg2+、Ca2+
(4)1 3 11 2 1 1.5 mol
本题解析:(1)提高酸浸浸取率的方法有很多,如加热、搅拌、延长浸取时间等。
(2)当pH=8时,Fe3+和Al3+都已经完全沉淀。
(4)先用化合价升降法配得Na2Cr2O7、SO2的化学计量数分别为1、3,然后再配平整个方程式。根据化学方程式,可知生成1 molCr(OH)(H2O)5SO4消耗SO2的物质的量为1.5 mol。
本题难度:一般
3、选择题 某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。分析其组成,现进行如下实验:
①取l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0. 03 mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0. 224L(假设丙全部逸出),最后沉淀完全溶解。下列推断正确的是
A.肯定有K+、Al3+、Mg2+、SO42-
B.肯定有K+、NH4+、Al3+、SO42-
C.肯定没有K+、HCO3-、MnO4-
D.肯定没有K+、NH4+、Cl-
参考答案:B
本题解析:溶液是无色的,则一定不存在MnO4-。根据①可知白色沉淀是硫酸钡,因此原溶液中含有0.03molSO42-。根据②可知原溶液中不存在Cl-、I-。另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0. 03 mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0. 224L(假设丙全部逸出),最后沉淀完全溶解,这说明白色沉淀一定是氢氧化铝,即含有0.01mol铝离子,因此不存在Mg2+、HCO3-。气体是氨气,物质的量是0.01mol,说明原溶液中含有0.01mol NH4+。根据溶液的电中性可知0.03mol×2>0.01mol×3+0.01mol,所以溶液中一定还含有钾离子,因此答案选B。
本题难度:一般
4、填空题 “探险队员”——稀硫酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多与稀硫酸反应的物质,稀硫酸必须避开它们,否则就无法通过。
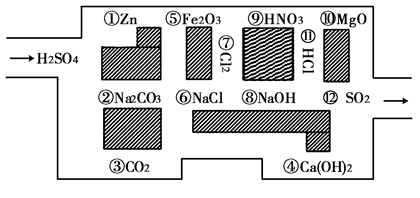
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)
________________。
(2)在不能与稀硫酸反应的物质中,属于电解质的是_______________(填写物质前的序号);在能与稀硫酸反应的化学反应中,属于氧化还原反应的是?(写出反应的离子方程式)。
(3)稀硫酸遇到②Na2CO3时,若不能反应说明理由,若能反应写出反应的化学方程式?。
参考答案:(7分)(1)③⑥⑦⑨
 ,(2分)
,(2分)
(2)⑥⑨ (2分);Zn+2H+==Zn2++H2↑(1分)
(2分);Zn+2H+==Zn2++H2↑(1分)
(3)Na2CO3+H2SO4="==" Na2SO4 +H2O+CO2↑(2分)
本题解析:(1)利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于稀硫酸不能和二氧化碳、氯化钠、二氧化硫、硝酸、盐酸、氯气反应,故答案为③⑥⑦⑨
 。
。
(2)⑥氯化钠⑨硝酸 盐酸在水溶液中能电离出自由移动的离子,属于电解质;,故答案为:⑥⑨
盐酸在水溶液中能电离出自由移动的离子,属于电解质;,故答案为:⑥⑨ 。①中的Zn和硫酸反应是氧化还原反应,离子方程式为Zn+2H+==Zn2++H2↑。
。①中的Zn和硫酸反应是氧化还原反应,离子方程式为Zn+2H+==Zn2++H2↑。
(3)稀硫酸遇到②Na2CO3时能发生反应,化学方程式为Na2CO3+H2SO4="==" Na2SO4 +H2O+CO2↑。
点评:本题主要考查了酸的化学性质及有关的置换反应和复分解反应条件的应用及电解质非电解质的定义,难度不是很大,培养学生对知识的应用能力和解决问题的能力。
本题难度:一般
5、选择题 无色透明溶液中能大量共存的是( )
A.Ca2+、Al3+、CO32ˉ、AlO2