1、选择题 将0.2摩MnO2和50毫升12mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
A.等于0.3摩
B.小于0.3摩
C.大于0.3摩,小于0.6摩
D.以上结论都不正确
参考答案:C
本题解析:50毫升12mol/L盐酸中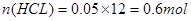 ;MnO2和盐酸反应的方程式为:
;MnO2和盐酸反应的方程式为: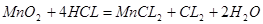 ,理论上0.2摩MnO2参加反应需消耗CL—的物质的量0.4mol,反应完成后溶液中
,理论上0.2摩MnO2参加反应需消耗CL—的物质的量0.4mol,反应完成后溶液中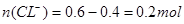 ;实际上,随着反应的不断进行,盐酸会逐渐变稀,稀盐酸与二氧化锰不反应,所以选项C比较接近;
;实际上,随着反应的不断进行,盐酸会逐渐变稀,稀盐酸与二氧化锰不反应,所以选项C比较接近;
本题难度:一般
2、选择题 海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是
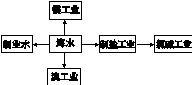
A.海水制淡水主要有蒸馏法、电渗析法、离子交换法等
B.海水制盐、发展氯碱工业都是发生物理变化
C.海水提溴过程中先通入Cl2将溴离子氧化为溴单质
D.工业上用电解熔融MgCl2的方法制取金属镁
参考答案:B
本题解析:A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等,正确;B、海水制盐是物理变化,但发展氯碱工业是电解饱和食盐水,产生了新物质有氯气、氢气单质、氢氧化钠生成,发生化学变化,错误;C、海水中的溴元素以溴离子形式存在,所以海水提溴过程中先通入Cl2将溴离子氧化为溴单质,再将溴吹出,正确;D、氧化镁的熔点较高,所以工业上用电解熔融MgCl2的方法制取金属镁,正确,答案选B。
本题难度:一般
3、实验题 (10分)在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去)。图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15 m L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
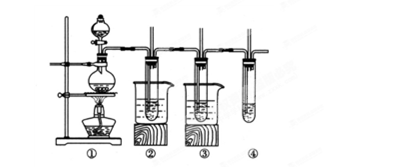
(1)③试管中制取次氯酸钠的化学方程式为?
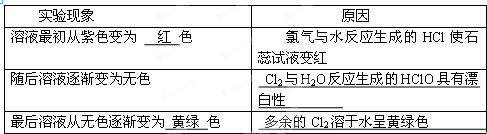
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格。
实验现象
| 原因
|
溶液最初从紫色变为 ?色
| 氯气与水反应生成的HCl使石蕊试液变红
|
随后溶液逐渐变为无色
| ?
|
最后溶液从无色逐渐变为?色
| ?
|
(3)此实验有一个明显的不足之处,应如何改进? ? ??
??
参考答案: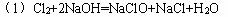
(2) 
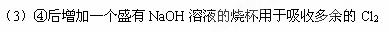
本题解析:略
本题难度:一般
4、选择题 氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是
A.灼热的铜丝在Cl2中剧烈地燃烧,产生棕黄色的烟
B.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
C.漂白粉是混合物,其有效成分是次氯酸钙
D.漂白粉放入稀盐酸中会降低漂白效果
参考答案:D
本题解析:A、灼热的铜丝在Cl2中剧烈地燃烧生成氯化铜,产生棕黄色的烟,A正确;B、氯气能与水反应生成HClO和HCl,次氯酸不稳定易分解生成氯化氢和氧气,因此久置氯水最终变为稀盐酸,B正确;C、漂白粉是次氯酸钙和氯化钙的混合物,其有效成分是次氯酸钙,C正确;D、漂白粉放入稀盐酸中产生次氯酸,会增强漂白效果,D不正确,答案选D。
本题难度:一般
5、选择题 将下列溶液分别加入到用氯气消毒过的自来水中,会产生沉淀的是
[? ]
A.AgNO3溶液?
B.NaNO3溶液?
C.NaCl溶液?
D.K2SO4溶液
参考答案:A
本题解析:
本题难度:简单