1、选择题 HClO是比碳酸还弱的酸,反应:Cl2+H2O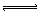 HCl+HClO达平衡后,要使HClO浓度增加,可加入?
HCl+HClO达平衡后,要使HClO浓度增加,可加入?
A.H2S(气)
B.HCl
C.CaCO3(固)
D.H2O
参考答案:C
本题解析:本题要求所加入的物质可破坏原化学平衡并增大[HClO]的浓度。
A项通入的为H2S气体是还原剂,而HClO具有氧化性,所以H2S一定会和HClO反应,故A不是答案。加入盐酸平衡向逆方向移动,也会减少HClO,故B也不是答案。加入CaCO3后CaCO3可与HCl反应,但不与HClO反应。因为三种酸的酸性由强至弱的顺序是HCl>H2CO3>HClO,所以盐酸能和碳酸钙反应,而HClO的酸性比H2CO3弱,所以不能与CaCO3反应,加入CaCO3可减小HCl浓度平衡向正方向移动而HClO不参加反应,其浓度增大。C为答案。加入水后,化学平衡虽能向正反应方向移动。但加水后溶液冲稀,HClO浓度也减小。
本题难度:一般
2、选择题 在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是
A.加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl-
B.新制氯水使红玫瑰变为白玫瑰,说明有Cl2
C.将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D.光照新制氯水有气泡逸出,该气体一定是Cl2
参考答案:A
本题解析:A 正确,氯离子和银离子反应得到氯化银白色沉淀,且不溶液稀硝酸
B 错误,说明有次氯酸,因为次氯酸有漂白性
C 错误,说明有盐酸,盐酸和KHCO3反应有气体产生,次氯酸和KHCO3不反应
D 错误,关照之后,次氯酸分解,产生盐酸和氧气,该气体一定是氧气。
本题难度:一般
3、选择题 下列物质间反应的离子方程式不正确的是(? )
A.Cl2通过FeBr2溶液中按1∶2物质的量的比反应:2Cl2+2Fe2++2Br-====4Cl-+2Fe3++Br2
B.过量小苏打溶液与澄清石灰水混合:Ca2++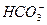 +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O
C.向漂白粉溶液中通入适量的SO2气体:Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO
D.Fe3O4溶于氢碘酸溶液中:Fe3O4+8H++2I-====3Fe2++I2+4H2O
参考答案:C
本题解析:C项中,CaSO3中的S元素为+4,会被HClO氧化,C项中的生成物应为CaSO4和HCl。
本题难度:简单
4、选择题 下列对实验现象的表述正确的是( )
A.将装有等量的NO2与N2O4混合气体的两个容积相同的玻璃球分别浸入热水和冷水中,浸入热水中的玻璃球里气体颜色较浅
B.红热的铜丝可以在氯气中燃烧,生成黑色的固体
C.将稀盐酸滴到二氧化锰固体上立即产生黄绿色气体
D.将白色的硫化锌固体浸入硫酸铜溶液中,会发现固体逐渐变为黑色
参考答案:A、2NO2?N2O4反应达到平衡,正向是放热反应,所以浸入热水中,平衡左移,气体颜色加深,故A错误;
B、红热的铜丝在氯气中燃烧发出棕黄色固体氯化铜,故B错误;
C、将稀盐酸滴到二氧化锰固体上不会反应产生氯气,故C错误;
D、将白色的硫化锌固体浸入硫酸铜溶液中,沉淀从白色转化为黑色,因为硫化锌比硫化铜的Ksp大,发生沉淀转化,向更难溶的方向进行,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 将氯水分别滴入下列溶液中,由实验现象得出的结论正确的是( )
| 选项 | ?氯水滴入下列溶液中 | ? 实验现象 | ? 结论
? A
滴有KSCN的FeCl2溶液
变红
Cl2具有还原性
? B
?KI-淀粉溶液
变蓝色
Cl2具有氧化性
? C
紫色石蕊溶液
先变红后褪色
Cl2具有漂白性
? D
滴有酚酞的NaOH溶液
褪色
Cl2具有酸性
|
A.A
B.B
C.C
D.D
参考答案:A、氯水滴入有KSCN的FeC12溶液中,氯气能将亚铁离子氧化为铁离子,铁离子遇KSCN溶液变红,则氯气具有氧化性,故A错误;
B、氯水滴入KI-淀粉溶液,氯气能将碘离子氧化为碘单质,碘单质遇淀粉变蓝,则氯气具有氧化性,故B正确;
C、氯水滴入紫色石蕊溶液中,氯气和水反应生成盐酸和次氯酸,酸使石蕊变红,次氯酸使其褪色,则次氯酸具有漂白性,而干燥的氯气不具有漂白性,故C错误;
D、氯水滴入有酚酞的NaOH溶液中,氯气和水反应生成酸,再发生酸碱中和,NaOH被反应掉,则颜色褪去,而氯气本身不能电离出氢离子,不具有酸性,故D错误;
故选B.
本题解析:
本题难度:简单