|
高考化学知识点归纳《物质的量》考点强化练习(2017年押题版)(十)
2018-03-17 08:21:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列溶液中含Cl-浓度最大的是( )
A.10m1 、0.1mol·L-1的AlC13溶液
B.20m1、 0.1mo1·L-1的CaC12溶液
C.30m1、 0.2mo1·L-1的KC1溶液
D.100m1 、0.25mo1·L-1的NaC1溶液
|
参考答案:A
本题解析:0.1mol·L-1的AlC13溶液c(Cl-)="0.3" mo1·L-1,0.1mo1·L-1的CaC12溶液c(Cl-)=0.2mol/L,0.2mo1·L-1的KC1溶液c(Cl-)=0.2mol/L,0.25mo1·L-1的NaC1溶液c(Cl-)="0.25" mo1·L-1。答案选A。
考点:物质的量浓度
点评:溶质中粒子的物质的量浓度与溶液的体积无关,至于溶质的浓度和溶质的组成有关系。
本题难度:一般
2、计算题 将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
参考答案:(1)1.12?(2)0.2?(3)①
本题解析:(1)根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2CO2=2Na2CO3+O2↑
2? 22.4L
7.8g/78g/mol? x
求得x=1.12L,故生成氧气的体积为1.12L;
(2)溶液物质的量浓度为0.1mol/500×10-3L=0.2mol/L;
(3)配制上述溶液时转移溶液后没有洗涤烧杯和玻璃棒会导致溶质转移的不完全,溶液浓度偏低;配制溶液时容量瓶中有少量水,对实验无影响;在定容时,俯视刻度线会导致蒸馏水的体积减少,浓度偏高。
本题难度:一般
3、选择题 若以ω1和ω2分别表示浓度为a mol/L和b mol/L硫酸溶液的质量分数,且知2a=b,则下列推断中,正确的是?(?)
A.2ω1=ω2
B.2ω2=ω1
C.ω1>2ω2
D.ω1<ω2<2ω1
参考答案:D
本题解析:硫酸溶液的浓度越高,溶液的密度越大,即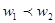 , ,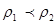 ,则质量分数与物质的量浓度的关系可知 ,则质量分数与物质的量浓度的关系可知 ; ;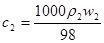 ;得 ;得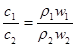 , ,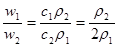 ,因 ,因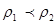 ,所以 ,所以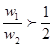 ,即得ω1<ω2<2ω1 ,即得ω1<ω2<2ω1
本题难度:一般
4、选择题 有不纯的CuCl2,质量为13.5 g,与适量AgNO3溶液反应,可生成29.g沉淀,则该氯化铜中所含的杂质是下列中的()
A.KCl
B.CaCl2
C.BaCl2
D.NaCl
参考答案:BD
本题解析:本题如果按常规思路解题,非常烦琐,甚至无从下手。但如果把AgCl沉淀的质量折算成氯元素的质量,根据“元素守恒”和“中间值法”巧解,则较为方便。
方法一:29 g AgCl沉淀中含氯元素的质量为:
29 g×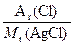 ="29" g× ="29" g×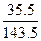 ="7.17" g ="7.17" g
13.5 g纯CuCl2中含氯元素的质量为:
13.5 g× ="13.5" g× ="13.5" g×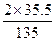 ="7.1" g ="7.1" g
因7.1 g<7.17 g,所以杂质中氯的质量分数>CuCl2中氯的质量分数。
通过比较,可知只有B、D选项符合题意。
方法二:极端假设法。
若13.5 g为纯CuCl2,则n(CuCl2)="0.1" mol,生成n(AgCl)="0.2" mol,AgCl沉淀质量为28.7 g,小于现有沉淀29 g,说明混入的杂质Cl-的含量应大于CuCl2中Cl-的含量。将选项中化学式变形:
A.2KCl? B.CaCl2?C.BaCl2?D.2NaCl
观察比较得知金属的相对原子质量小于CuCl2中Cu(64)的CaCl2和NaCl满足题意。
本题难度:简单
5、实验题 (16分)实验室为完成某一实验,需用240mL1.0mol/L的稀盐酸,现用11.8mol/L的浓盐酸配制,填空并请回答下列问题:
(1)配制完成某一实验所需1.0mol/L的盐酸溶液,应量取浓盐酸体积为 mL,所用到的玻璃仪器除量筒、烧杯、玻璃棒外还要用到有 、 等。
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) →D。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.改用某仪器加水,使溶液凹液面恰好与刻度相切
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作 ;C操作时不慎有少量液体溅出容量瓶外 ;定容时俯视_____________。
(4)10.6gNa2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是__________升。
参考答案:(1)21.2;胶头滴管,250 mL容量瓶(没指明容量0分)
(2)BCAEF→D(顺序有错得0分);
(3)偏低;偏低;偏高
(4)2.24
本题解析:(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,设需要钠元素的体积为V,则:
1mol/L×250mL=11.8mol/L×V,解得:V=21.2mL,配制240mL 1mol?L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故还需要的仪器有:胶头滴管,250 mL容量瓶。故答案为:21.2;胶头滴管,250 mL容量瓶;(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓盐酸,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2-3次,并将洗涤液移入容量瓶,继续注入蒸馏水至液面距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线水平相切,盖好瓶塞,反复颠倒摇匀,故实验操作顺序为:BCAEFD。故答案为:BCAEF;
(3)没有进行洗涤烧杯,少量HCl沾在烧杯内壁上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏低,移液时不慎有少量液体溅出容量瓶外,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏低,定容时俯视,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏高,故答案为:偏低,偏低,偏高.
(4)10.6gNa2CO3的物质的量为10.6/106=0.1mol,盐酸足量,碳酸钠完全反应,根据碳原子守恒可知,生成二氧化碳的物质的量为0.1mol,所以二氧化碳的体积为0.1×22.4=2.24L。
考点:一定物质的量浓度溶液的配制,根据方程式的计算。
本题难度:一般
|