1、实验题 某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
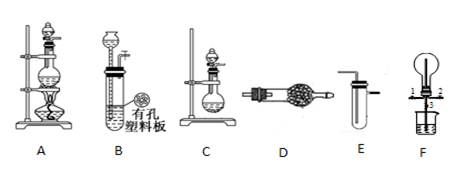
Ⅰ探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与?(填装置编号)连接;装置C中的烧瓶内固体宜选用?。
a.碱石灰? b.氯化钙? c.五氧化二磷? d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是?。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入?,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子?。
Ⅱ探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是?。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式?。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为?;F的烧杯所起的作用是?。
参考答案:(1)D;ad
(2)饱和食盐水;浓硫酸
(3)氯气;取少量固体于试管中,加入适量浓NaOH溶液,并且加热,在管口用湿润的红色石蕊试纸检验所产生的气体,如果试纸变蓝,则证明该固体是铵盐,含有NH4+。
(4)装置E中的NaBr溶液变成橙红色
(5)CH2=CH2+Br2=CH2Br—CH2Br
(6)SO2+2H2S=3S↓+2H2O;吸收尾气
本题解析:(1)制取氨气可用加热浓氨水,用碱石灰干燥,但不能用五氧化磷及氯化钙干燥,氨气会与氯化钙反应;
(2)制取干燥的氯气,先用饱和食盐水除去HCl,再用浓硫酸干燥;
(3)向烧瓶中先通入氯气,然后再通入氨气,因氯气有颜色,用利于观察。一开始先通入NH3,由于弹簧夹3打开,容易形成喷泉。证明NH4+存在,切记实验设计的环节。
(4)利用氧化性Cl2置换Br2来说明阴离子的还原性强弱;
本题难度:一般
2、选择题 当不慎有大量Cl2扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某种物质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是(?)
A.NaOH
B.NaCl
C.NaHCO3
D.NH3·H2O
参考答案:C
本题解析:NaOH有强腐蚀性;NH3·H2O对人有很强的刺激作用;NaCl不能与Cl2反应,所以A、B、D选项错误;NaHCO3无腐蚀性,吸收Cl2,因氯气溶于水生成盐酸和次氯酸,都能与NaHCO3反应,氯气的吸收能力强且快。故选C。
本题难度:一般
3、选择题 下列关于氯水的说法正确的是
A.向氯水中通入少量二氧化硫,氯水的漂白性增强
B.氯水中加入NaCl固体,对溶液的pH无影响
C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L
D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O
参考答案:C
本题解析:A、向氯水中通入少量二氧化硫发生氧化还原反应生成盐酸和硫酸,氯水的漂白性减弱,A不正确;B、氯水中加入NaCl固体,溶液中氯离子浓度增大,则使平衡H2O+Cl2 H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
本题难度:一般
4、选择题 下列属于物理变化的是
A.氯气溶于水
B.食物变质
C.用四氯化碳萃取碘水中的碘
D.光合作用
参考答案:C
本题解析:化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。A、氯气溶于水,与水反应生成氯化氢和次氯酸,属于化学变化.故选项错误;B、食物变质的过程中有对人体有害的新物质生成,属于化学变化,故选项错误;C、萃取过程中没有新物质生成,属于物理变化.故选项正确;D、光合作用中有新物质生成,属于化学变化,故选项错误;故选C。
本题难度:简单
5、填空题 如图所示,将等物质的量的Cl2和CH4充入一容积为 25 mL的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是;
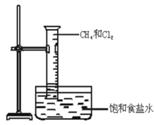
①?
②?
③?
④?
参考答案:气体的黄绿色变浅,最后为无色? 有油状液滴附着在量筒内壁
饱和食盐水中有晶体析出? 量筒内气体体积减小,液面上升
本题解析:在光照的条件下氯气和甲烷发生取代反应生成卤代烃和氯化氢,卤代烃不能溶于水,氯化氢极易溶于水,所以实验中可以观察到的实验现象是气体的黄绿色变浅,最后为无色;有油状液滴附着在量筒内壁;饱和食盐水中有晶体析出;量筒内气体体积减小,液面上升。
点评:该题是基础性试题的考查,试题基础性强,难易适中。侧重对基础知识的巩固和训练的,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生规范严谨的实验设计能力,也有助于调动学生的学习兴趣和学习积极性,提升学生的学科素养。
本题难度:一般