1、填空题 黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.100?0g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020?0?mol/L的K2Cr2O7
标准溶液滴定至终点,消耗,K2Cr2O7溶液25.00?mL。 ?
已知:SO2+2Fe3+?+2H2O=SO42-?+2Fe2+?+4H+ ?Cr2O2-?+6Fe2+?+14H+=2Cr3+?+6Fe3+?+7H2O?
(1)样品中FeS2的质量分数是(假设杂质不参加反应)____________________。 ?
(2)若灼烧69?FeS2产生的SO2全部转化为SO3气体时放出9.8?3kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式:
________________________。 ?
(3)煅烧10?t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______L,制得98%的硫酸质量为_______t,SO2全部转化为H2SO4时放出的热量是________kJ。
参考答案:(1)90.00%
(2)SO3(g)?+?H2O(1)=H2SO4(1)?;?△H=-130.3?kJ/mol
(3)3.36×106;15;3.43×107
本题解析:
本题难度:一般
2、填空题 2005年我国成功发射“神州”六号载人飞船,标志着我国航天技术走在了世界前列。肼(N2H4)是发射航天飞船常用的高能燃料。在火箭推进器中分别装有肼和过氧化氢,当它们混合时即产生气体,并放出大量的热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式____________________。
参考答案:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.625kJ/mol
本题解析:
本题难度:一般
3、填空题 下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
族
周期
| IA
|
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
|
2
|
|
|
| ②
| ③
| ④
|
|
|
3
| ⑤
|
| ⑥
| ⑦
|
|
| ⑧
|
|
(1)④、⑤、⑥的原子半径由大到小的顺序为(元素符号)________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)若用①②组成最简单的有机物作为燃料电池的原料,请写出在碱性介质中燃料电池负极的电极反应式: 。
(7)燃煤废气中的含有氮氧化物(NOx)、二氧化碳等气体,常用下列方法对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物。
如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) , △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) , △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
参考答案:(1)Na>Al>O……(2分)
(2)HNO3>H2CO3>H2SiO3 (H4SiO4) ……(2分)
(3)NaOH或NaClO……(2分)
(4)2Mg + CO2 2MgO + C……… (2分)
2MgO + C……… (2分)
(5)2Al + 2OH- + 2H2O =2AlO2- + 3H2↑………(2分)
(6)CH4-8e- +10OH-=CO32- +7H2O………(2分)
(7)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1 … (2分)
本题解析:根据元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,则
(1)Na、Al位于同一周期,Na原子半径大于Al,O原子核外电子层数最少,原子半径最小,则原子半径:Na>Al>O;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则酸性:HNO3>H2CO3>H2SiO3。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物为NaOH或NaClO。
(4)由②和④组成的化合物可以是二氧化碳或一氧化碳,⑤的同周期相邻主族元素的单质是镁,镁能与二氧化碳反应生成氧化镁和碳,反应的化学方程式为2Mg + CO2 2MgO + C。
2MgO + C。
(5)⑥单质是铝,与⑤的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al + 2OH- + 2H2O =2AlO2- + 3H2↑。
(6)①②组成最简单的有机物是甲烷,甲烷作为燃料电池中甲烷在负极通入,所以在碱性介质中燃料电池负极的电极反应式为CH4-8e- +10OH-=CO32- +7H2O。
(7)已知①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1、②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1,则根据盖斯定律可知(①+②)÷2即得到CH4(g)将NO2(g)还原为N2(g)等的热化学方程式,即CH4(g) +2NO2(g)=N2(g) +CO2(g) +2H2O(g),所以该反应的反应热△H=(-574 kJ·mol-1-1160 kJ·mol-1)÷2=-867 kJ·mol-1。
考点:考查元素周期表和元素周期律的综合应用
本题难度:困难
4、填空题 (1)常温下有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,比较盐酸、HX、HY、HZ四种酸酸性由强到弱
(2)已知25°C时:
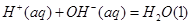

氢氟酸是一种弱酸,可用来刻蚀玻璃。20ml0.1mol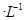 的氢氟酸与0.1mol/L
的氢氟酸与0.1mol/L
氢氧化钠溶液完全反应时放热aJ,写出氢氟酸电离的热化学方程式
参考答案:HCl 、HX、HY、HZ
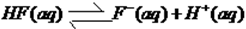 △H==+(57.3-0.5a)kJ/mol
△H==+(57.3-0.5a)kJ/mol
本题解析:(1)酸越弱,相应的钠盐越容易水解,碱性越强,所以根据钠盐的pH的相对大小可知,盐酸、HX、HY、HZ四种酸酸性由强到弱HCl 、HX、HY、HZ。
(2)反应中生成水是0.002mol,所以生成1mol水放出的热量0.5akJ。则根据盖斯定律可知,1mol氢氟酸电离吸热是(57.3-0.5a)kJ,因此热化学方程式为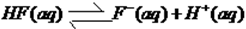 △H==+(57.3-0.5a)kJ/mol
△H==+(57.3-0.5a)kJ/mol
本题难度:一般
5、选择题 下列热化学方程式中,正确的是( ? )
A.甲烷的燃烧热△H=-890.3?kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3?kJ?mol-1
B.一定条件下,将0.5?mol?N2和1.5?mol?H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6?kJ?mol-1
C.在101?kPa时,2gH2完全燃烧生成液态水,放出285.8?kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6?kJ?mol-1
D.HCl和NaOH反应的中和热△H=-57.3?kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1
参考答案:C
本题解析:
本题难度:简单