1、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示。下列说法正确的是

A.元素W的最高价氧化物对应的水化物的酸性比Q的强
B.原子半径的大小顺序为:X>Y>Z>W>Q
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素Y与元素W的最高化合价的数值等于其族序数
参考答案:A
本题解析:由元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素。A、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故Q的最高价氧化物的水化物的酸性较强,A正确;B、原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:rZ>rW>rQ>rX>rY,B错误;C、离子Y2-和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,C错误;D、氧元素一般没有正化合价,最高化合价不等于族序数,D错误;选A。
本题难度:一般
2、选择题 与Na+具有相同电子数和质子数的微粒是(?)
A.NH4+
B.F-
C.NH3
D.OH-
参考答案:A
本题解析:根据钠的原子序数为11,则Na+具有11个质子数,因原子变为阳离子要失去电子,则电子数为10,然后判断选项来分析解答。
A、NH4+中具有11个质子数和10个电子,则与Na+具有相同质子数和电子数,故A正确;
B、F-中有9个质子和10个电子,则不与Na+具有相同质子数和电子数,故B错误;
C、NH3中有10个质子和10个电子,而Na+具有11个质子数和10个电子,故C错误;
D、OH-中具有9个质子和10个电子,则不与Na+具有相同质子数和电子数,故D错误;
故选A。
点评:题考查微粒中的质子数和电子数,学生应注意中性微粒质子数等于电子数,离子中质子数=电子数±电荷数。
本题难度:一般
3、选择题 A、B、C为短周期主族元素,原子序数依次增大,B、C同周期,A与B的最外层电子数之和等于C的质子数,A的最外层电子数是次外层电子数的2倍。下列说法正确的是
A.原子半径大小:A<B<C
B.A、B、C三种元素的非金属性:A>B>C
C.B形成的化合物只能含有共价键
D.A与C所形成的分子可能是非极性分子
参考答案:D
本题解析:A的最外层电子数是次外层电子数的2倍,因此A是碳元素。又因为ABC的原子序数依次增大,且B、C同周期,A与B的最外层电子数之和等于C的质子数,所以B是氮元素,C是氟元素。同周期自左向右原子半径逐渐减小,非金属性逐渐增强,所以AB都不正确。C也不正确,例如氮元素和活泼的金属形成的化合物是离子化合物。D增强,例如四氟化碳是非极性分子,答案选D。
本题难度:一般
4、填空题 (13分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
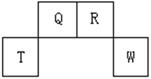
(1)W在周期表中的位置是?, Q、R、T三种元素原子的半径从大到小排列顺序?(用元素符号表示),Q的最高价氧化物的电子式?,R气态氢化物分子的结构式为?;
(2)元素的原子得电子能力:Q?W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点?(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是?(填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号?,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号?。