1、选择题 元素周期表里金属元素和非金属元素分界线附近的元素可能用于(? )
A.制新农药
B.制半导体材料
C.制新医用药物
D.制高温合金
参考答案:B
本题解析:金属和非金属分界线附近元素,既有一定的金属性,也有一定的非金属性,可用于制半导体材料。
本题难度:简单
2、选择题 下图是元素周期表短周期的一部分,Y、W的质子数之和为25。下列说法正确的是
?
A.非金属性:W>Z?
B.原子半径:X<Y
C.Z的最高价氧化物可溶于Y的氢化物的水溶液
D.Y的最高价氧化的水化物酸性强于W最高价氧化的水化物
参考答案:AC
本题解析:设Y的原子序数是x则W的原子序数是x+7,所以2x+7=25,解得x=9,所以Y是F元素,则X、Z、W分别是N、Si、S元素。A、根据元素周期律判断,非金属性:W>Z,正确;B、X、Y是同周期元素,所以原子半径:X>Y,错误;C、二氧化硅不溶于大部分酸,但能溶于HF溶液,正确;D、元素F无正价,,所以不存在最高价氧化的水化物,错误,答案选AC。
本题难度:一般
3、选择题 低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是
A.Fe位于元素周期表的第四周期、第ⅧB族
B.Q460比纯铁的硬度大
C.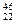 TiO2、
TiO2、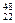 TiO2、
TiO2、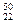 TiO2互为同位素
TiO2互为同位素
D.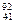 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
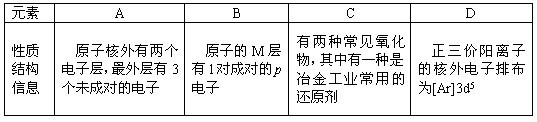
⑴写出B原子的电子排布式?。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点?(填“高”或“低”),其原因是?。
⑶D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为K4[D(CN)6],则中心原子D的化合价为?,甲在水溶液中的电离方程式为?;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为?。
 ⑷下列分子结构图中的“? ”表示上述相关元素的原子中除去最外层电子的剩余部分,“? ”表示氢原子,小黑点“? ”表示没有形成共价键的最外层电子,短线表示共价键。
⑷下列分子结构图中的“? ”表示上述相关元素的原子中除去最外层电子的剩余部分,“? ”表示氢原子,小黑点“? ”表示没有形成共价键的最外层电子,短线表示共价键。
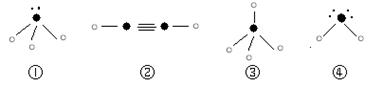
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是?(填写序号);在②的分子中有?个σ键。
参考答案:
⑴ 1s22s22p63s23p4(2分)
⑵高(1分)?因为A的氢化物分子间存在氢键(2分)
⑶+2(1分)? K4[D(CN)6]=4K++[Fe(CN)6]4—(2分)?K3[Fe(CN)6] (2分)
⑷②(2分)? 3 (2分)
本题解析:略
本题难度:简单
5、计算题 由第IIA族金属单质A和第IIIA族金属单质B组成的混合物1.29g ,用过量的盐酸其完全溶解后生成的氢气 在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的的相对原子质量。
在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的的相对原子质量。
参考答案:
本题解析:略
本题难度:简单