1、填空题 (8分)有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
(1)Y 元素的名称______________;
(2)W 在元素周期表中的位置是第____________周期第____________族;
(3)X2M2中存在的化学键有_______________________;
(4)Z、W氢化物的稳定性顺序为__________________;
(5)用电子式表示X2Z 的形成过程____________________________。
参考答案:(1)硅
(2)三?ⅤⅡA?
(3)离子键?共价键
(4)? HCL>H2S
(5)略
本题解析:略
本题难度:一般
2、选择题 同种元素的不同微粒,它们的?
A.质量数一定相同
B.核外电子数一定相同
C.电子层数可能不同
D.原子量一定相同
参考答案:C
本题解析:本题提出的主语是“同种元素的不同微粒”,这些微粒包括不同同位素的原子和离子。对于A,质量数=质子数+中子数,不同种的同位素中子数不同,所以质量数不相同,原叙述错误。对于B,原子得失电子后,转变成为离子,原子与离子的核外电子数是不相同的,原叙述错误。对于C,金属原子失去最外层电子转变成阳离子,如钠原子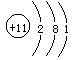 转变成钠离子
转变成钠离子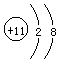 ,电子层数少了一层,电子层数不相同,原叙述正确。
,电子层数少了一层,电子层数不相同,原叙述正确。
对于D,本题所指“同种元素的不同微粒”当然包括不同同位素的原子,不同同位素的原子量是不相同的,原叙述错误。
本题难度:一般
3、选择题 短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是(?)
A.原子序数A>B
B.电子总数A->B2+
C.离子半径A->B2+
D.原子半径A>B
参考答案:C
本题解析:因为离子A-和B2+具有相同的电子层结构,即可确定元素A、B在周期表中的相对位置如下: ,所以原子序数B>A,原子半径:B>A,离子的电子层结构相同,则电子总数相等,离子半径A->B2+。
,所以原子序数B>A,原子半径:B>A,离子的电子层结构相同,则电子总数相等,离子半径A->B2+。
本题难度:一般
4、选择题 下列判断错误的是
A.沸点:NH3>PH3>AsH3
B.稳定性:HF>HCl>HBr>HI
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
参考答案:A
本题解析:由于氨气分之间存在氢键,所以氨气的沸点在同主族元素的氢化物中沸点最高,其余的自上而下逐渐降低,所以选项A不正确,应该是NH3>AsH3>PH3。非金属性越强,相应氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,B、C正确。同样金属性越 强,最高价氧化物的水化物的碱性越强,D正确,答案选A。
本题难度:简单
5、选择题 已知SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是(?)
A.ABn型分子中A、B均不含氢原子
B.A元素的相对原子质量必小于B元素的相对原子质量
C.分子中所有原子都在同一平面上
D.分子中A原子最外层电子都已成键
参考答案:D
本题解析:选项A中ABn型分子中,A、B不含氢原子,反例CH4为非极性分子;选项B的反例为CCl4;C的反例CH4、CCl4等都是立体结构。所以选项A、B、C都不正确。
本题难度:简单