|
高考化学知识点总结《盐类水解的原理》试题预测(2017年最新版)(八)
2018-03-17 08:48:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 将0.5mol的下列物质溶于500ml水中,,含阴离子数目最多的是
A.CaCO3
B.CH3COONa
C.NH3
D.Na2SO3
参考答案:D
本题解析:
本题难度:困难
2、选择题 下列水解离子方程式正确的是:
A.CO32-+H2O CO2 +2OH- CO2 +2OH-
B.I-+H2O HI+OH- HI+OH-
C.SO32-+2H2O H2SO3+2OH- H2SO3+2OH-
D.HPO42- +H2O H2PO4- +OH- H2PO4- +OH-
|
参考答案:D
本题解析:A中CO32-水解分布进行,且不可能生成CO2,不正确;B中I-不水解,不正确;C中SO32-水解分布进行,不正确,答案选D。
考点:考查水解方程式的判断
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练。该题的关键是明确盐类水解的含义以及特点,然后灵活运用即可,难度不大。
本题难度:一般
3、填空题 (11分)(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)相同物质的量浓度的Na2CO3溶液与NaHCO3溶液,pH大小:Na2CO3________NaHCO3(填“>”、“=”或“<”)。
(3)在配制FeCl3溶液时,应加入__________,目的是_____________。
(4)Na2S溶液中滴入酚酞溶液显______色,原因是__________________。(用离子方程式表示),
(5)将氯化铝溶液蒸干并灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
参考答案:(1)<; (2)>;(3) 盐酸,抑制FeCl3水解;(4)红,S2-+H2O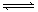 HS-+OH-,HS-+H2O HS-+OH-,HS-+H2O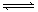 H2S+OH-;(5)Al2O3,Al2(SO4)3。 H2S+OH-;(5)Al2O3,Al2(SO4)3。
本题解析:(1) NH4+水解生成NH3?H2O和H+,溶液呈酸性,则pH<7;(2)两溶液水解呈碱性,Na2CO3以第一步水解为主,Na2CO3的水解程度大于NaHCO3,所以Na2CO3的PH大于NaHCO3;(3) FeCl3水解产生Fe(OH)3和HCl,在配制FeCl3溶液时,应加入盐酸,抑制FeCl3水解;(4)硫化钠水解,S2-+H2O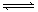 HS-+OH-,HS-+H2O HS-+OH-,HS-+H2O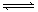 H2S+OH-,溶液显碱性,滴入酚酞试液,溶液呈红色;(5)加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝;加热促进硫酸铝水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铝。 H2S+OH-,溶液显碱性,滴入酚酞试液,溶液呈红色;(5)加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝;加热促进硫酸铝水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铝。
考点:考查盐类水解及溶液中离子浓度大小关系比较。
本题难度:一般
4、填空题 (选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
参考答案:(1)④②③①;(2)⑥⑦④⑤⑧;(3)c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)>;9:2
本题解析:(1)根据水的离子积以及水电离出c(H+)=c(OH-),假设温度是常温下,①0.1mol·L-1H2SO4溶液中的OH-来自水,c(OH-)=  =5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)= =5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)= 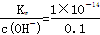 =1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O =1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即: CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即: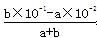 =10-2,解得:a:b=9:2。 =10-2,解得:a:b=9:2。
考点:考查水的离子积的计算、弱电解质的电离、影响盐类水解的因素、pH的计算等相关知识。
本题难度:困难
5、选择题 下列有关说法正确的是
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.等浓度的氨水和氯化铵按体积比2:3混合,溶液中存在:2c(Cl-)=3[c(NH4+)+c(NH3.H2O)]
C.0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
D.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的值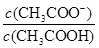 增大到原来的10倍 增大到原来的10倍
|  ,推导出
,推导出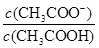 =c(H+)×K,pH从3.0升到4.0时,
=c(H+)×K,pH从3.0升到4.0时,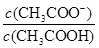 增大到原来的10倍,正确。
增大到原来的10倍,正确。