| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》试题预测(2017年最新版)(十)
参考答案:C 本题解析:溶液加热蒸干、灼烧后所得固体成分的判断要考虑①水解型②分解型③氧化型。A、加热时促进Al3+水解,盐酸易挥发,生成Al(OH)3,灼烧的氧化铝固体,错误;B、KHCO3不稳定,加热易分解,所得固体成分为K2CO3,错误;C、加热时虽然促进Fe3+水解,但硫酸难挥发,硫酸和氢氧化铁反应生成Fe2(SO4)3,最后固体仍为Fe2(SO4)3,正确;D、NH4HCO3不稳定,加热易分解生成氨气、水和二氧化碳,无固体剩余,错误。 本题难度:一般 2、选择题 用0.1000mol/LNaOH溶液滴定20.00mlH2A溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图所示。下列有关说法错误的是 |
参考答案:D
本题解析:由图像可知当加入0.1000mol/LNaOH溶液40ml时,刚好滴定完全,故H2A的物质的量浓度为0.1000mol.L-1,A项说法正确;恰好完全反应时,溶液pH值为9.7,故H2A是二元弱酸,B项说法正确;20ml时溶液溶质刚好为NaHA,故a-b段发生反应HA-+OH-=H2O+A2-,C项说法正确;.a点时溶液pH值为4.7,显酸性,故a点时HA-的水解程度小于电解程度,D项说法错误;本题选D。
考点:酸碱中和滴定。
本题难度:困难
3、选择题 某有机物的结构简式如图,它在一定条件下可能发生的反应类型是( )
①加成?②水解?③酯化?④消去?⑤中和?⑥氧化?⑦还原.
A.①③④⑤⑥⑦
B.①③④⑤⑦
C.①③⑤⑥⑦
D.②③④⑤⑥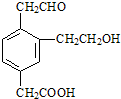
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列有关说法正确的是
A.常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
C.常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中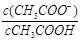 的值增大到原来的10倍
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-)
参考答案:C
本题解析:A、根据质子守恒,有c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;B、c(OH-)=c(H+),说明溶液呈中性,因为HA的酸性的强弱未知,所以与氢氧化钠恰好完全反应得到的NaA溶液不一定是中性溶液,可能是碱性溶液,错误;C、常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,氢离子浓度缩小为原来的1/10倍, =Ka/ c(H+),醋酸的电离常数不变,氢离子浓度缩小10倍,则比值增大到原来的10倍,正确;D、根据电荷守恒,常温下pH=7的溶液为中性溶液,则c(Na+)=c(CH3COO-) >c(CH3COOH) >c(H+)=c(OH-),错误,答案选C。
=Ka/ c(H+),醋酸的电离常数不变,氢离子浓度缩小10倍,则比值增大到原来的10倍,正确;D、根据电荷守恒,常温下pH=7的溶液为中性溶液,则c(Na+)=c(CH3COO-) >c(CH3COOH) >c(H+)=c(OH-),错误,答案选C。
考点:考查电解质溶液中离子浓度的比较,守恒规律的应用
本题难度:困难
5、填空题 (1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是 ;②若为弱酸强碱盐,其水解的离子方程式是 。
参考答案:(1)A∶B=10-4∶1;(2)产生白色沉淀,且红色褪去 在纯碱溶液中C水解:C+H2O HC+OH-,加入BaCl2后Ba2++C
HC+OH-,加入BaCl2后Ba2++C BaCO3↓(白色),由于C的浓度减小,水解平衡左移,OH-浓度减小,酚酞溶液褪色
BaCO3↓(白色),由于C的浓度减小,水解平衡左移,OH-浓度减小,酚酞溶液褪色
(3)①An++nH2O A(OH)n+nH+ ②Bm-+H2O
A(OH)n+nH+ ②Bm-+H2O HB(m-1)-+OH-
HB(m-1)-+OH-
本题解析:(1)在pH=9的NaOH溶液中,c(H+)=10-9 mol·L-1,其H+全部是水电离产生的,因为c(H+)水=c(OH-)水,即A=10-9 mol·L-1。在CH3COONa溶液中,由于CH3COO-结合了水中的H+,水的电离平衡向正反应方向移动,c(OH-)增大;在pH=9的CH3COONa溶液中,c(OH-)=1×10-5 mol·L-1,其OH-全部是水电离产生的,即B=10-5 mol·L-1,所以,A∶B=10-9 mol·L-1∶10-5 mol·L-1=10-4∶1。(3)正确地表示An+、Bm-符号及Bm-水解产物HB(m-1)-至关重要。
考点:盐类水解的原理
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的组成.. | |