1、选择题 只用一种试剂可区别Na2SO4、AlCl3、NH4Cl、CuSO4四种溶液,这种试剂是( )
A.HCl
B.BaCl2
C.AgNO3
D.NaOH
参考答案:A.加入盐酸,不发生任何反应,不能鉴别,故A错误;
B.加入BaCl2不能鉴别Na2SO4和CuSO4,故B错误;
C.加入硝酸银,四种物质都能生成沉淀,不能鉴别,故C错误;
D.加入NaOH溶液,Na2SO4不反应,AlCl3生成白色沉淀,NaOH过量,沉淀溶解,NH4Cl有刺激性气体生成,CuSO4生成蓝色沉淀,可鉴别,故D正确.
故选D.
本题解析:
本题难度:一般
2、实验题 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。 ?
⑴提出假设?①该反应的气体产物是CO2。?②该反应的气体产物是CO。③该反应的气体产物是__________。?
设计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

⑵查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:______________。?
⑶实验步骤 ?
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。步骤②、④中都分别通入N2,其作用分别为_____________。
⑷数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:________________________。
参考答案:⑴CO2、CO的混合物
⑵NH4++NO2-?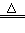 N2↑+2H2O
N2↑+2H2O
⑶步骤②中是为了排尽空气,步骤④是为了赶出所有的CO2,确保完全吸收
⑷2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
本题解析:
本题难度:一般
3、填空题 “化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生.如图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:A、稀硫酸;B、锌粒;C、某溶液;D、CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水请回答下列问题:
(1)反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是______.
(2)装置D 中的离子方程式______,该反应的类型是______,装置F中的离子方程式______.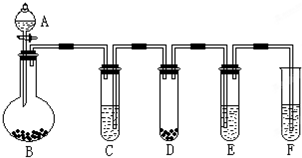
参考答案:“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需要控制第一个反应.
(1)应开始后,若E中滴有紫色石蕊试液的蒸馏水出现红色,说明有酸性气体生成;F中足量的澄清石灰水有白色沉淀生成,气体可能为二氧化碳或二氧化硫等,因为D中是碳酸钙固体,F中是澄清石灰水,所以该气体只能是二氧化碳,稀盐酸和稀硝酸都可和碳酸钙反应生成二氧化碳,所以C中的物质可能是稀盐酸或稀硝酸,
故答案为:稀盐酸或稀硝酸;
(2)碳酸钙和酸反应生成钙离子、水和二氧化碳,碳酸钙、水和二氧化碳写化学式,所以装置D中的离子方程式离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑;该反应是酸和盐反应生成另外的酸和盐,所以是复分解反应;二氧化碳使澄清的石灰水变浑浊,二氧化碳和氢氧化钙反应生成碳酸钙和水,所以装置F中反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O
故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;复分解反应;CO2+Ca2++2OH-═CaCO3↓+H2O.
本题解析:
本题难度:一般
4、选择题 下列实验装置(部分固定装置略去)和有关叙述正确的是
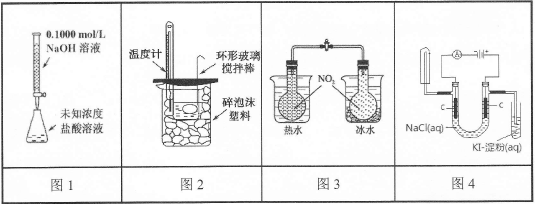
A.图1可以进行酸碱中和滴定实验
B.图2可以进行中和热的测定实验
C.图3可验证温度对化学平衡的影响
D.图4可检验食盐水通电后的部分产物
参考答案:CD
本题解析:A、NaOH溶液能腐蚀磨口玻璃塞,不能装入酸式滴定管,错误;B、温度计应置于烧杯内的环形玻璃搅拌棒中,测量减小误差,错误;C、加热、冷却可以探究温度对2NO2(g) N2O4(g)的影响规律,正确;D、电解食盐水生成的气体产物分别是氢气、氯气,正确。
N2O4(g)的影响规律,正确;D、电解食盐水生成的气体产物分别是氢气、氯气,正确。
本题难度:一般
5、实验题 为了证明化学反应有一定的限度,进行了如下探究活动:
探究活动一:取5mL0.1?的KI溶液于试管,滴加0.1?的FeCl3溶液5~6滴,振荡;
探究活动二:在上述试管中加入2mLCCl4,充分振荡、静置;
探究活动三:取上述静置分层后的上层水溶液于试管,滴加0.1?的KSCN溶液5~6滴,振荡。
(1)探究活动一和探究活动二的实验现象分别为_______、_________。写出探究活动一中的反应的离子方程式___________________。
(2)在探究活动三中,实验者的意图是通过生成血红色的Fe(SCN)3,来验证有Fe3+残留,从而证明化学反应有一定的限度。但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与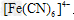 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想:
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想:
①各取2mL“探究活动三所得溶液”于试管A、B,请将相关的实验操作、预期现象和结论填入下表:
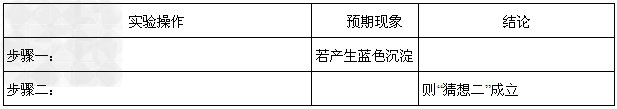
②写出操作“步骤一”中发生反应的离子方程式:_____________________。
参考答案:(1)溶液呈棕黄色;溶液分为两层,下层CCl4层呈紫色;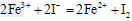
(2)①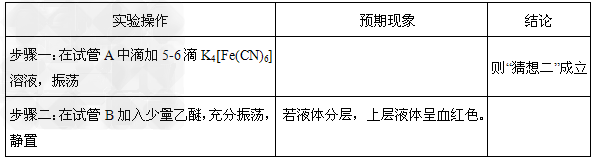 ②
②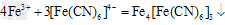
本题解析:
本题难度:一般