1、填空题 有关元素X、Y、Z、W的信息如下:
元素
| 有关信息
|
X
| 原子半径为0.074 nm,其氢化物的结构模型可表示为:
|
Y
| 原子半径为0.102 nm,其原子核外电子排布为: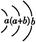
|
Z
| 人体中必需微量元素中含量最多,体内缺失会引起贫血
|
W
| 所在主族序数与所在周期序数之差为4
|
?
请回答下列问题:
(1)W在元素周期表中的位置是?。
(2)Y与W相比,非金属性较强的是?(填元素符号),下列事实能证明这一结论的是?(填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z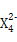 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z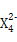 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明)?。
参考答案:(1)第3周期ⅦA族 (2)Cl a、c、d
(3)Fe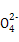 的还原产物为Fe3+,能发生水解反应,Fe3++3H2O
的还原产物为Fe3+,能发生水解反应,Fe3++3H2O Fe(OH)3(胶体)+ 3H+ ,生成的氢氧化铁胶体有吸附作用,起到净水作用
Fe(OH)3(胶体)+ 3H+ ,生成的氢氧化铁胶体有吸附作用,起到净水作用
本题解析:由X的氢化物的结构模型可知X为O;由Y的原子核外电子排布可知a=2,b=6,即Y为S;根据表中Z的有关信息可知Z为Fe;又因W所在主族序数与所在周期序数之差为4,可推知W应为Cl,故(1)Cl在第3周期ⅦA族;(2)非金属强弱的判断方法有:气态氢化物的稳定性,其最高价含氧酸的酸性强弱、非金属之间的置换反应,故a、c、d正确;(3)Z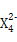 即Fe
即Fe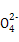 的还原产物为Fe3+,能发生水解反应,Fe3++3H2O
的还原产物为Fe3+,能发生水解反应,Fe3++3H2O Fe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,起到净水作用。
Fe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,起到净水作用。
本题难度:一般
2、选择题 下列叙述正确的是(?)
A.13C和14C属于同一种元素,它们互为同位素
B.2H和3H是不同的核素,它们的质子数不相等
C.14C和14N的质量数相等,它们的中子数相等
D.6Li和7Li的电子数相等,中子数相等
参考答案:A
本题解析:13C和14C属于同一种元素,但中子数不同,它们互为同位素,A正确;2H和3H是不同的核素,属于同一种核素,它们的质子数相等,B不正确;14C和14N的质量数相等,但它们的中子数相等,分别是8和7,C不正确;6Li和7Li的电子数相等,但中子数不相等,分别是3和4,D不正确,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:一般
3、填空题 (15分).I下表是部分短周期元素的原子半径及主要化合价:
元素代号[
| W
| R
| X
| Y
| Z
| Q
| M
|
原子半径/nm
| 0.037
| 0.186
| 0.074
| 0.075
| 0.077
| 0.150
| 0.160
|
主要化合价
| +1
| +1
| -2
| -3、+5
| +2、+4
| +3
| +2
|
试用元素符号 、化学式回答下列问题:
、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是?。
M在Z的最高价氧化物中燃烧的化学方程式?。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有?;
X可与W组成含18电子的化合物乙,则乙的电子式为?。
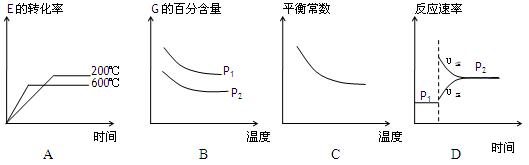
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g) 2G(g)根据下表中的数据判断下列图像错误的是?。
2G(g)根据下表中的数据判断下列图像错误的是?。

| p1(MPa)
| P2(MPa)
|
200
| 78.4
| 90.6
|
600
| 72.3
| 88.6
|
?
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由?极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由?极(填a或b)通入,写出下列条件下负极电极反应方程式。
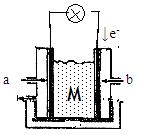
(1)若M为氢氧化钾溶液,?
(2)若M为熔融的碳酸钾??
(3)若M为传递O2-的固体电解质??
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4 ,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液?mL恰好能使溶液中的金属离子沉淀完全。
参考答案:(15分)I.第三周期IA族;(1分)? 2Mg+CO2="=2MgO+C?" (1分)
 (2)离子,共价键;(1分)? H∶O∶O∶H(1分)
(2)离子,共价键;(1分)? H∶O∶O∶H(1分)
(3)BD(2分)
II? a (1分)
(1)CH3OH –6e-?+8 OH- = CO32-+6H2O(2分)
(2) CH3OH –6e- +3 CO32- = 4CO2 +2H2O(2分)
(3) CH3OH –6e- +4O2- = CO32- +2H2O(2分)
III? 300mL(2分)
本题解析:略
本题难度:一般
4、选择题 下列能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定? ②HClO4酸性比H2SO4强? ③Cl2能与H2S反应生成S? ④Cl原子最外层有7个电子,S原子最外层有6个电子? ⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS? ⑥盐酸是强酸,而氢硫酸是弱酸
A.①②③④⑤⑥
B.①②③④⑥
C.①②③⑤
D.②④⑥
参考答案:C
本题解析::①元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,可说明非金属性:Cl>S,故①正确;②元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,HClO4酸性比H2SO4强,可说明非金属性:Cl>S,故②正确;
③Cl2能与H2S反应生成S,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故③正确;
④不能以最外层电子数的多少判断非金属性的强弱,例如O的最外层电子数为6,I的最外层电子数为7,但O的非金属性大于I,故④错误;
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故⑤正确;
⑥比较非金属性的强弱,应根据对应的最高价氧化物对应的水化物的酸性比较,不能根据氢化物的酸性进行比较,例如HF的酸性比HCl弱,但非金属性F大于Cl,故⑥错误。
故选C。
点评:本题考查非金属性的强弱比较,题目难度不大,注意比较非金属性的角度和方法。
本题难度:一般
5、填空题 下表是元素周期表的一部分,针对所给的元素,完成下列各小题。
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
2
| ?
| ?
| ?
| C
| N
| O
| ?
|
3
| Na
| ?
| Al
| Si
| ?
| S
| Cl
|
?
21. 第3周期中金属性最强的元素是?(填元素名称)。
22. C、N和O原子半径由小到大的顺序的是?。
23. 第3周期中气态氢化物最稳定的是?(填化学式)。
24. Si是带来人类文明的重要元素之一,其氧化物化学式是?。
25. 铝是大自然赐予人类的宝物。它的一个用途是发生铝热反应,冶炼某些难熔金属,写出
该反应的一个化学方程式?。
26. S元素形成的氢化物与其氧化物SO2相遇后的现象是?。
参考答案:21. 钠;22. O<N<C;23. HCl;24. SiO2;
25. 2Al+Fe2O3 2Fe+Al2O3;26. 生成淡黄色固体
2Fe+Al2O3;26. 生成淡黄色固体
本题解析:21. 第3周期中金属性最强的元素在周期表的最左侧,是钠。
22. 同一主族元素的半径随原子序数的递增而减小。故原子半径由小到大的顺序的是O<N<C;
23. 第3周期中最稳定的气态氢化物是非金属性最强的元素组成的,是HCl;
24. Si元素的化合价为+4,其氧化物化学式是SiO2;
25. 冶炼某些难熔金属铝热反应2Al+Fe2O3 2Fe+Al2O3;
2Fe+Al2O3;
26. S元素形成的氢化物与其氧化物SO2相遇:2H2S+SO2→3S+2H2O,现象生成淡黄色固体。
本题难度:一般