1、填空题 有关元素X、Y、Z、W的信息如下:
元素
| 有关信息
|
X
| 原子半径为0.074 nm,其氢化物的结构模型可表示为:
|
Y
| 原子半径为0.102 nm,其原子核外电子排布为: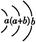
|
Z
| 人体中必需微量元素中含量最多,体内缺失会引起贫血
|
W
| 所在主族序数与所在周期序数之差为4
|
?
请回答下列问题:
(1)W在元素周期表中的位置是?。
(2)Y与W相比,非金属性较强的是?(填元素符号),下列事实能证明这一结论的是?(填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z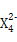 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z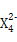 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明)?。
2、选择题 下列叙述正确的是(?)
A.13C和14C属于同一种元素,它们互为同位素
B.2H和3H是不同的核素,它们的质子数不相等
C.14C和14N的质量数相等,它们的中子数相等
D.6Li和7Li的电子数相等,中子数相等
3、填空题 (15分).I下表是部分短周期元素的原子半径及主要化合价:
元素代号[
| W
| R
| X
| Y
| Z
| Q
| M
|
原子半径/nm
| 0.037
| 0.186
| 0.074
| 0.075
| 0.077
| 0.150
| 0.160
|
主要化合价
| +1
| +1
| -2
| -3、+5
| +2、+4
| +3
| +2
|
试用元素符号 、化学式回答下列问题:
、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是?。
M在Z的最高价氧化物中燃烧的化学方程式?。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有?;
X可与W组成含18电子的化合物乙,则乙的电子式为?。
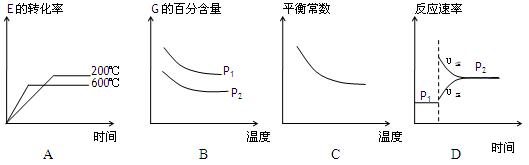
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g) 2G(g)根据下表中的数据判断下列图像错误的是?。
2G(g)根据下表中的数据判断下列图像错误的是?。

| p1(MPa)
| P2(MPa)
|
200
| 78.4
| 90.6
|
600
| 72.3
| 88.6
|
?
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由?极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由?极(填a或b)通入,写出下列条件下负极电极反应方程式。
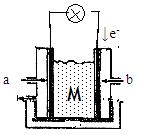
(1)若M为氢氧化钾溶液,?
(2)若M为熔融的碳酸钾??
(3)若M为传递O2-的固体电解质??
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4 ,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液?mL恰好能使溶液中的金属离子沉淀完全。
4、选择题 下列能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定? ②HClO4酸性比H2SO4强? ③Cl2能与H2S反应生成S? ④Cl原子最外层有7个电子,S原子最外层有6个电子? ⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS? ⑥盐酸是强酸,而氢硫酸是弱酸
A.①②③④⑤⑥
B.①②③④⑥
C.①②③⑤
D.②④⑥
5、填空题 下表是元素周期表的一部分,针对所给的元素,完成下列各小题。
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
2
| ?
| ?
| ?
| C
| N
| O
| ?
|
3
| Na
| ?
| Al
| Si
| ?
| S
| Cl
|
?
21. 第3周期中金属性最强的元素是?(填元素名称)。
22. C、N和O原子半径由小到大的顺序的是?。
23. 第3周期中气态氢化物最稳定的是?(填化学式)。
24. Si是带来人类文明的重要元素之一,其氧化物化学式是?。
25. 铝是大自然赐予人类的宝物。它的一个用途是发生铝热反应,冶炼某些难熔金属,写出
该反应的一个化学方程式?。
26. S元素形成的氢化物与其氧化物SO2相遇后的现象是?。