1、推断题 主族元素R的最高价氧化物R2O 4.7g溶于95.3g水中,所得溶液的质量分数为5.6%,R原子核中含有20个中子;主族元素Q,其单质能与水剧烈反应放出O2,并能跟R形成典型的离子化合物RQ。试通过计算求:
(1)R和Q各为什么元素(写出推导过程);________________________________________。
(2)写出R和Q在元素周期表中的位置;_____________________________________ ___。
(3)将4.7g R2O溶于多少克水中,使每50个水分子溶有1个R+(写出计算过程)。________________________________________。
参考答案:(1)R为K元素,Q为F元素。
(2)R在第4周期ⅠA族,Q在第2周期ⅦA族。
(3)90.9g
本题解析:(1)设R的相对原子质量为M,生成ROH的质量为x。
R2O+H2O?=== 2ROH
2M+16 2(M+17)
4.7g x

w(ROH)= ×100%=5.6%
×100%=5.6%
M=39。则R原子核内质子数为39-20=19,为K。又因Q能与水反应置换O2,并能跟R形成离子化合物RQ,则Q为-1价元素,为ⅦA族,则Q为F。
(2)R在第4周期,ⅠA族;Q在第2周期,ⅦA族。
(3)K2O +H2O===2KOH
94g 18g 2mol
4.7g m(H2O) n(KOH)
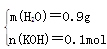
共需水:0.9g+0.1mol×50×18g/mol=90.9g。
点评:本题考查的是元素周期表的应用和化学计算的性质,题目难度中,考查学生对周期表的掌握程度及化学计算的能力。
本题难度:一般
2、选择题 据报道,放射性同位素钬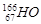 可有效冶疗肝癌,该同位素原子核内的中子数与质子数之差为(?)
可有效冶疗肝癌,该同位素原子核内的中子数与质子数之差为(?)
A.32
B.67
C.99
D.166
参考答案:A
本题解析:中子数与质子数分别为99、67该同位素原子核内的中子数与质子数之差为32
本题难度:简单
3、填空题 (11分)(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构。
① 写出元素符号:A?,D?,E?。
② B、C的最高价氧化物对应水化物相互反应的离子方程式为:
?。
③ 写出A2D的电离方程式:?,?。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。N? P? AS ?;O? S? Se分别是VA族、VIA族连续三元素。?
①根据元素周期律,预测:酸性强弱 H3AsO4 ?H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度?。(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是_________________。
参考答案:(1)①H? S? K?②Al(OH)3 + OH-=AlO2- + 2H2O?③H2S  ?H+ + HS-
?H+ + HS-
HS- ?H+ + S2-?(2)①<?②4?③c(H+)> c(Br-)> c(SO42-)>c(OH-)
?H+ + S2-?(2)①<?②4?③c(H+)> c(Br-)> c(SO42-)>c(OH-)
本题解析:(1)A的原子核中没有中子,则A为氢元素;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5,令B、D质子数分别为x、y,则x+y=27,y-x=5,解得x=11,y=16,故B为钠元素,D为硫元素;C的单质跟足量盐酸反应,生成C3+和氢气,则C为铝元素;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构,E形成+1价离子,离子核外有18个电子,则E为钾元素。①由分析可知,A为H,D为S,E为K。②B、C的最高价氧化物对应水化物为NaOH、Al(OH)3,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,二者相互反应的离子方程式为OH-﹢Al(OH)3=AlO2-﹢2H2O;③H2S 的电离方程式为H2S  ?H+ + HS-?HS-
?H+ + HS-?HS- ?H+ + S2-;(2)①根据同主族元素性质递变规律:同主族元素最高价氧化物水化物的酸性由上到下逐渐增强知:酸性强弱 H3AsO4 <H3PO4。②S位于VIA族,最高正价为+6价,负价为-2价,代数和为4;根据同主族元素由上到下单质与氢化合越来越难知在相同条件下Se与H2反应的限度比S与H2反应限度更小;③将SO2气体通入溴水恰好完全反应离子方程式为Br2 + SO2 +2H2O=2Br- + 2H+ + SO42-,溶液中存在的离子浓度由大到小的顺序是c(H+)> c(Br-)> c(SO42-)>c(OH-)。
?H+ + S2-;(2)①根据同主族元素性质递变规律:同主族元素最高价氧化物水化物的酸性由上到下逐渐增强知:酸性强弱 H3AsO4 <H3PO4。②S位于VIA族,最高正价为+6价,负价为-2价,代数和为4;根据同主族元素由上到下单质与氢化合越来越难知在相同条件下Se与H2反应的限度比S与H2反应限度更小;③将SO2气体通入溴水恰好完全反应离子方程式为Br2 + SO2 +2H2O=2Br- + 2H+ + SO42-,溶液中存在的离子浓度由大到小的顺序是c(H+)> c(Br-)> c(SO42-)>c(OH-)。
本题难度:一般
4、选择题 下表列出短周期8种元素的部分性质,有关叙述不正确的是 (? )
原子
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径
(10-10m)
| 0.74
| 1.52
| 1.60
| 1.10
| 0.99
| 0.75
| 1.86
| 0.82
|
最高价/
最低价
| -2
| +1
| +2
| +5
-3
| +7
-1
| +5
-3
| +1
| +3
|
?
A.②号元素原子半径小于⑦号元素的原子半径
B.④号元素原子序数大于⑥号元素的原子序数
C.②号元素和③号元素处在同一周期
D.⑤号元素最高价氧化物对应的水化物的酸性比其他7种元素的最高价氧化物对应的水化物的酸性都强
参考答案:C
本题解析:②号与⑦号元素都是碱金属元素,②在⑦上边,②号元素的原子半径小,A正确;④号与⑥号元素都是第ⅤA族元素,⑥在④上边,⑥号元素原子序数小,B正确;②号与③号元素若在同一周期,则②号元素原子半径应该大于③号元素原子半径,C错;⑤号元素最高价氧化物对应的水化物是HClO4。
本题难度:一般
5、填空题 (共7分)有七种金属:钾、锌、铁、锡、铜、银、铂,它们的标号分别为A、B、C、D、E、F、G。①常温下,只有A和水反应生成氢气;②D、E、G都能和稀硫酸反应生成氢气,B、C、F无此性质;③C、F组成原电池时,F为正极;④在G的硫酸盐溶液中加入D,发现D溶解,G析出;⑤将G、E接触放置,E不易锈蚀;⑥以铂作电极,电解相同浓度的B和C的硝酸盐溶液时,在阴极上首先得到C,G在空气中放置极易生锈。则A是___?_,B是___?_,C是__?__,D是_?___,E是_?___,F是____?,G是____?
参考答案:A:K? B:Cu? C:Ag? D:Zn? E:Sn ?F:Pt? G:Fe
本题解析:考查金属性强弱比较。根据①可知A的金属性最强,所以A是K。根据③可知C的金属性强于F的。根据④可知,金属性是D强于G。根据⑤可知,金属性是E小于G。又因为G易生锈,所以G是铁,因此根据②可知,D是Zn,E是Sn。根据⑥可知B的金属性强于C,所以根据②可知Cu,C是Ag,F是Pt。
本题难度:一般