1、选择题 下列实验事实不能用平衡移动原理解释的是( )
A.

?
将NO2球浸泡在冷水和热水中
B.
| t/℃ | 25 | 50 | 100
KW/10-14
1.01
5.47
55.0
|
C.
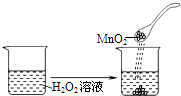
D.| C(氨水)/(mol?L-1) | 0.1 | 0.01
pH
11.1
10.6
|
参考答案:A.存在平衡2NO2?N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A不选;
B.水是弱电解质,存在电离平衡H2O?H++OH-,电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故B不选;
C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C选;
D.氨水中存在平衡NH3?H2O?NH4++OH-,浓度越稀,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,故D不选;
故选C.
本题解析:
本题难度:简单
2、选择题 将1?mol?H2(g)和2?mol?I2(g)置于某2?L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?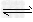 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
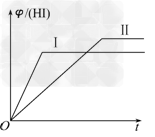
[? ]
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
参考答案:C
本题解析:
本题难度:一般
3、选择题 在一定温度下将各1mol CO和水蒸气放在密闭的容器中反应: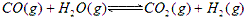 达到平衡后,测得
达到平衡后,测得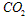 为0.6mol,再通入4mol水蒸气,达到平衡后的
为0.6mol,再通入4mol水蒸气,达到平衡后的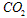 物质的量为
物质的量为
[? ]
A.等于0.6mol
B.等于1mol
C.大于0.6mol小于1mol
D.大于1mol
参考答案:C
本题解析:
本题难度:一般
4、选择题 对于平衡体系mA(g)+nB(g)?pC(g)+qD(g)△H<0.下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol
D.保持其它条件不变,升高温度,平衡向正反应方向移动
参考答案:A、若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,说明平衡逆向进行,逆向是气体体积减小的反应,m+n<p+q,故A正确;
B、若平衡时,A、B的转化率相等,转化率是转化量除以起始量计算,说明反应开始时,A、B的物质的量之比为m:n,故B正确;
C、若m+n=p+q,明反应前后气体体积不变,气体物质的量不变,则向含有a mol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,故C正确;
D、保持其它条件不变,升高温度,平衡向逆反应方向移动,故D错误;
故选D.
本题解析:
本题难度:简单
5、填空题 牙齿表面由一层硬的、组成为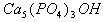 的物质保护着,它在唾液中存在下列平衡:
的物质保护着,它在唾液中存在下列平衡: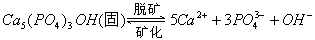 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是__________。 已知
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是__________。 已知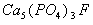 (固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋牙的原因_________________________。 根据以上原理,请你提出一种其他促进矿化的办法:____________________。
(固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋牙的原因_________________________。 根据以上原理,请你提出一种其他促进矿化的办法:____________________。
参考答案:生成的酸性物质,能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿;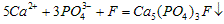 ;加入Ca2+或PO43-。
;加入Ca2+或PO43-。
本题解析:
本题难度:一般