1、选择题 除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A.苯酚与溴水反应,生成三溴苯酚与苯互溶;
B.应加入过量的氢气;
C.乙酸乙酯在碱性条件下水解;
D.新制生石灰与水反应,可减少乙醇中水的量.
解答:A.苯酚与溴水反应,生成三溴苯酚与苯互溶,不能得到纯净物质,故A错误;
B.应加入过量的氢气,引入了新的杂质氢气,不符合除杂原则,故B错误;
C.乙酸乙酯在碱性条件下水解,应用饱和碳酸钠溶液分离,故C错误;
D.新制生石灰与水反应,可减少乙醇中水的量,然后蒸馏可制备无水乙醇,故D正确.
故选D.
点评:本题考查物质的分离提出,题目难度不大,注意把握相关物质的性质的异同,为解答该类题目的关键.
本题难度:困难
2、选择题 下列事实,不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D.实验室用排饱和食盐水而不用排水法收集氯气
参考答案:B
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,这就是勒夏特列原理。AC是温度引起的,D是浓度引起的。B中反应前后体积不变,所以改变压强平衡不移动。颜色变深是因为容积减小,气体的浓度增大引起的,答案选B。
本题难度:一般
3、选择题 下列肯定能达到目的是
①用一种试剂就能鉴别下列七瓶无色溶液: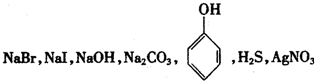
②不用任何其他试剂可以鉴别下列四瓶无色溶液:BaCl2,NaOH,Na2CO3,(NH4)2CO3.
A.只有①能达到目的
B.只有②能达到目的
C.①②都达不到目的
D.①②都能达到目的
参考答案:D
本题解析:分析:①根据阴离子的不同,可用FeCl3鉴别;
②四种溶液相互滴加,可产生不同的现象,能鉴别.
解答:①七瓶无色溶液中分别加入FeCl3,NaBr无现象;NaI溶液呈黄褐色或紫色;NaOH溶液生成红棕色沉淀;Na2CO3与FeCl3发生互促水解,分别生成红棕色沉淀和无色气体,苯酚变成紫色;H2S溶液中有浅黄色或乳白色沉淀产生;AgNO3产生白色沉淀,可鉴别,故①正确;
②四瓶无色溶液:BaCl2、NaOH、Na2CO3、(NH4)2CO3,相互滴加时,现象如下表: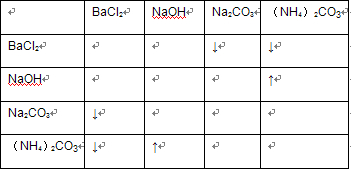 ,可鉴别,故②正确,
,可鉴别,故②正确,
故选D.
点评:本题考查物质的鉴别和检验,题目难度中等,注意把握相关物质的性质,熟练把握相关物质的性质以及反应的现象是解答该题的关键.
本题难度:简单
4、选择题 已知25℃时,有关弱酸的电离平衡常数:
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中
E.一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:A
本题解析:试题分析:根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。酸越弱,相应的钠盐越容易水解,pH越大,A不正确,应该是pH(Na2CO3)>pH(NaCN)> pH(CH3COONa);B正确,C正确,因为根据电荷守恒可知c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=9.9×10-7。D正确,符合电荷守恒,答案选A。
考点:考查溶液中离子浓度大小比较
点评:比较溶液中离子浓度大小比较时,应该遵循几个守恒关系式,即电荷守恒定律、物料守恒和质子守恒。
本题难度:困难
5、填空题 (8分)在下列化学方程式中,指出氧化剂和还原剂,氧化产物和还原产物。
(1)3S+6KOH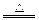 K2SO3+2K2S+3H2O
K2SO3+2K2S+3H2O
(2)S+2KNO3+3C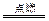 K2S+N2+3CO2
K2S+N2+3CO2
(1)氧 化 剂 还 原 剂 氧化产物 还原产物
(2)氧 化 剂 还 原 剂 氧化产物 还原产物
参考答案:(1)S;S;K 2SO3;K2
2SO3;K2 S (2)
S (2) S、KNO3;C;CO2;K2S,N2
S、KNO3;C;CO2;K2S,N2
本题解析:略
本题难度:一般