1、选择题 下列叙述正确的是
[? ]
A.某醋酸溶液的pH =a,将此溶液稀释1倍后,溶液的pH =b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH <7
C.1.0×10-3 moI/L盐酸的pH= 3.0,1.0×10-8 mol/L盐酸的pH= 8.0
D.若l mL pH =1的盐酸与100 mL NaOH溶液混合后,溶液的pH =7,则NaOH溶液的pH =11
参考答案:D
本题解析:
本题难度:一般
2、简答题 室温下,将浓度相同,体积比为3:2的NaOH和HCl溶液混合,所得混合液的pH等于12,则原溶液的浓度为( )
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L
参考答案:设原溶液的浓度都为c,溶液的体积分别为3V和2V,则混合后,
n(OH-)=3cV-2cV=cV,
c(OH-)=nV=cV5V=c5=10-2mol/L,
c=0.05mol/L,
故选C.
本题解析:
本题难度:一般
3、简答题 常温下,将0.05mol?L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12.用上述NaOH溶液12.5mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA.
(1)此一元弱酸的物质的量浓度为______;
(2)此条件下该一元弱酸的电离平衡常数为______.
参考答案:(1)设氢氧化钠的浓度为xmol/L,盐酸和氢氧化钠混合溶液中c(OH-)=2x-0.05×11+2mol/L=10-1410-12mol/L,
2x-0.051+2=0.01,x=0.04,
氢氧化钠和HA以1:1反应,NaOH溶液12.5mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,
设HA的浓度为ymol/L,
0.04mol/L×0.0125L=ymol/L×0.002L,
y=0.04×0.01250.002=0.025,
故答案为:0.025mol?L-1;
(2)电离平衡常数K=c(H+).c(A-)c(HA)=10-3×10-30.025-10-3=4.5×10-5,
故答案为:4.5×10-5.
本题解析:
本题难度:一般
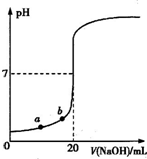
4、选择题 用0.1000mol?L-1 NaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示.下列说法正确的是( )
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100mol?L-1?
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3