1、选择题 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为 +
+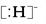
D.它与水反应的离子方程式为NH4++H-+H2O NH3·H2O+H2↑
NH3·H2O+H2↑
参考答案:A
本题解析:NH5中所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则可以预测它是铵盐,其中有氢负离子。1 mol NH5中含有4 NA个N—H键,故A项错误;铵盐中既有离子键又有共价键,B正确;C、 D项都正确。
本题难度:一般
2、填空题 (10分)(1)(6分)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是:?其反应的离子方程式为:?.?
(2)(4分)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为?和??。其中心原子的杂化方式分别是?和?
参考答案:(1)(6分)形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。(2分)? Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O(2分)
(2)(4分)平面三角形?三角锥形? sp2? sp3?(各1分)
本题解析:(1)硫酸铜和氨水反应生成蓝色的氢氧化铜沉淀,但氨水过量时,氢氧化铜能溶解在氨水中形成配合物,是由现象是形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O。
(2)CO32-和SO32-的中心原子含有的孤对电子分别是(4+2-2×3)÷2=0、(6+2-2×3)÷2=1,是由前者是平面三角形,后者三角锥形。因此中心原子的杂化类型分别是sp2杂化和sp3杂化。
本题难度:一般
3、选择题 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法中错误的是( )
A.X、Y、Z形成的单质中,X的单质最稳定
B.Y所在周期中所有主族元素,Y的原子半径最小
C.Z所在族中元素的最高正价均为+6价
D.能发生Cl2+H2Z=Z+2HCl的反应
