1、填空题 写出下列物质在水溶液中的电离方程式.
①一水合氨:______
②碳酸氢钙:______
③硫酸氢铵:______.
参考答案:①一水合氨的电离方程式为:NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-;
②碳酸氢钙的电离方程式为:Ca(HCO3)2=Ca2++2HCO3-,故答案为:Ca(HCO3)2=Ca2++2HCO3-;
③硫酸氢铵的电离方程式为:NH4HSO4=NH4++H++SO42-,故答案为:NH4HSO4=NH4++H++SO42-.
本题解析:
本题难度:一般
2、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-) 的操作是
[? ]
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通CO2
④向水中通NH3
⑤向水中加入明矾晶体
⑥向水中加入NaHCO3固体
⑦向水中加NaHSO4固体
A .①③⑥⑦
B .①③⑤⑥
C .⑤⑦
D .⑤
参考答案:D
本题解析:
本题难度:一般
3、选择题 常温下,下列离子能使纯水中的H+离子数目增加的是( )
A.S2-
B.I-
C.NH4+
D.Na+
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
[? ]
A.胶体与其他分散系的本质区别是能否发生丁达尔现象
B.一定温度下,任何酸、碱、盐的水溶液中,c(H+)·c(OH-)均为一定值
C.在可逆反应中,改变一个影响化学平衡的条件,其正、逆反应速率必然同时改变
D.船底镶嵌锌块,锌失电子,保护船体免受腐蚀
参考答案:D
本题解析:
本题难度:一般
5、选择题 25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
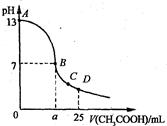
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml
参考答案:D
本题解析:根据电荷守恒,c(CH3COO-)+c(OH—)=c(Na+)+c(H+),C点溶液呈酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH—),故A正确;D点时c(CH3COO-)+c(CH3COOH)=2c(Na+),符合物料守恒,故B正确;当加入及少量醋酸时,c(OH-)>c(CH3COOˉ),故C错误;a=12.5ml时,氢氧化钠和醋酸恰好完全反应,此时溶液呈碱性,故D错误。
考点:本题考查化中和滴定。
本题难度:一般