1、填空题 (12分)有关硫化物的几个问题。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g) 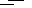 2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
②S(s) + O2(g) 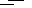 SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
参考答案:(1)2H2S(g)+3O2(g) 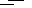 2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol (2)① H2SO3
2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol (2)① H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ (每个1分,共2分) ② 降低 ③ HCO3 —+ H+
SO3 2—+ H+ (每个1分,共2分) ② 降低 ③ HCO3 —+ H+ 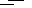 CO2 ↑+ H2O(2分)
CO2 ↑+ H2O(2分)
④提高脱硫海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用。(3)CuSO4
SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用。(3)CuSO4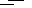 Cu 2++SO42-,ZnS(s)
Cu 2++SO42-,ZnS(s) Zn(aq) +S2-(aq),Cu 2(aq)++ S2-(aq)
Zn(aq) +S2-(aq),Cu 2(aq)++ S2-(aq) 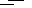 CuS(s)
CuS(s)
本题解析:(1)将①+②×2可得H2S(g)与O2(g)反应的化学方程式,则其ΔH=-442.38 kJ/mol+ (-297.04 kJ/mol )×2=-1036.46 kJ/mol,所以H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是:2H2S(g)+3O2(g) 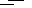 2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol 。(2)①H2SO3是二元中强酸,分步电离。电离方程式为:H2SO3
2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol 。(2)①H2SO3是二元中强酸,分步电离。电离方程式为:H2SO3 HSO3—+ H+ 、HSO3—
HSO3—+ H+ 、HSO3— SO3 2—+ H+ ②会发生反应:2SO2+ 2H2O+O2
SO3 2—+ H+ ②会发生反应:2SO2+ 2H2O+O2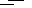 2H2SO4,产生了强酸所以pH降低。③溶解了SO2的海水显酸性,与HCO3 —反应的离子方程式为HCO3 —+ H+
2H2SO4,产生了强酸所以pH降低。③溶解了SO2的海水显酸性,与HCO3 —反应的离子方程式为HCO3 —+ H+ 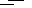 CO2 ↑+ H2O 。④大量鼓入空气可以提高氧气的浓度,将SO32-氧化成为SO42-,有利于平衡H2SO3
CO2 ↑+ H2O 。④大量鼓入空气可以提高氧气的浓度,将SO32-氧化成为SO42-,有利于平衡H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用。(3)CuSO4遇到ZnS转化为CuS是一个沉淀的转化过程,溶解度大的沉淀转化为溶解度小的沉淀,发生的反应有:CuSO4
SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用。(3)CuSO4遇到ZnS转化为CuS是一个沉淀的转化过程,溶解度大的沉淀转化为溶解度小的沉淀,发生的反应有:CuSO4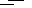 Cu 2++SO42-,ZnS(s)
Cu 2++SO42-,ZnS(s) Zn(aq) +S2-(aq),Cu 2+(aq)+ S2- (aq)
Zn(aq) +S2-(aq),Cu 2+(aq)+ S2- (aq)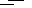 CuS(s)
CuS(s)
考点:热化学方程式的计算、离子方程式的书写和沉淀转化。
本题难度:困难
2、填空题 (13分)
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
参考答案:Ⅰ、 1)② ④ ① ③ ⑤ (2分)
2)、5HSO3- + 2IO3- = I2 +5SO42- +3H+ +H2O (2分)
3)H2和NH3 (2分) ; Mg+2NH4+===Mg2++2NH3 ↑+H2 ↑ (2分)
Ⅱ、(1)①Al(OH)3 (1分) ②B (1分)
(2)不含有(1分) , Fe3+完全沉淀时,c(OH-)3= =4.0×10-33,c(Al3+)·(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。(2分)
=4.0×10-33,c(Al3+)·(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。(2分)
本题解析:等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,其中②(NH4)2CO3溶于水电离出NH4+、CO32—,NH4+与CO32—水解相互促进,造成水的电离程度最大,④KHCO3溶于水电离出K+、HCO3—,HCO3—水解促进了水的电离,①、③、⑤电离均对水的电离产生抑制,且⑤为强电解质,对水的电离程度抑制最大,所以⑤中水的电离程度最小,由电离常数可知HSO3—的电离程度大于NH3·H2O的电离程度可知KHSO3对水的电离抑制程度大于NH3·H2O对水的电离的抑制程度,故这五种水溶液中水的电离程度由大到小的顺序为②>④>①>③>⑤;读题NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘可知该反应发生反应的离子为HSO3—与IO3—,IO3—被还原为I2,HSO3—被氧化为SO42—,离子方程式为:5HSO3- + 2IO3- = I2 +5SO42- +3H+ +H2O;在浓NH4Cl溶液中存在NH4++H2O NH3·H2O+H+,溶液呈酸性,加入镁单质,镁会消耗H+产生H2,使平衡右移,并且放热,NH3·H2O热稳定性差,分解为NH3和H2O,故产生气体为H2、NH3,整理的方程式为Mg+2 NH4+===Mg2++2NH3 ↑+H2 ↑;由于溶度积常数Ksp[Cu(OH)2]=2.2×10-20>Ksp[Al(OH)3]=1.1×10-33,在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成Al(OH)3沉淀,用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,则应使MgCl2、AlCl3同时接触过量的氨水,所以应先向反应器中加入氨水再滴加入MgCl2、AlCl3溶液;由于要使Fe3+完全沉淀时则c(OH-)3=
NH3·H2O+H+,溶液呈酸性,加入镁单质,镁会消耗H+产生H2,使平衡右移,并且放热,NH3·H2O热稳定性差,分解为NH3和H2O,故产生气体为H2、NH3,整理的方程式为Mg+2 NH4+===Mg2++2NH3 ↑+H2 ↑;由于溶度积常数Ksp[Cu(OH)2]=2.2×10-20>Ksp[Al(OH)3]=1.1×10-33,在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成Al(OH)3沉淀,用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,则应使MgCl2、AlCl3同时接触过量的氨水,所以应先向反应器中加入氨水再滴加入MgCl2、AlCl3溶液;由于要使Fe3+完全沉淀时则c(OH-)3= =4.0×10-33,若此时c(Al3+)=0.2 mol·L-1,则c(Al3+)·c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。
=4.0×10-33,若此时c(Al3+)=0.2 mol·L-1,则c(Al3+)·c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。
考点:难溶电解质的溶解平衡及溶度积常数应用。
本题难度:困难
3、填空题 (6分)(1)(2分)用水稀释0.1mol/L氨水,溶液中随着水量的增加而减小的是_______(填字母)

(2)(4分)已知25℃时,Ksp(CaSO4)==7.10×10-5.向0.100L含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,若溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______ (填“增大”、“减小”或“不变”,下同), Ksp(CaSO 4)将________。
4)将________。
参考答案:(1)BD? (2) 增大?不变
本题解析:略
本题难度:一般
4、填空题 Al(OH)3为两性氢氧化物,在水溶液中存在酸式电离和碱式电离两种形式,试根据平衡移动反应物质,解释下列有关问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_________________,有关离子方程式是___________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是__________________,有关离子方程式是______________________。
参考答案:(1)Al(OH)3的碱式电离为Al(OH)3 Al3++3OH-,加入盐酸溶液,由于H+与Al(OH)3电离出来的少量
Al3++3OH-,加入盐酸溶液,由于H+与Al(OH)3电离出来的少量
OH-中和生成水,使Al(OH)3的电离平衡向电离方向移动;Al(OH)3+3H+==Al3++3H2O
(2)Al(OH)3的酸式电离为Al(OH)3+H2O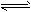 H++[Al(OH)4]-,当向Al(OH)3沉淀中加入碱溶液时,OH-与
H++[Al(OH)4]-,当向Al(OH)3沉淀中加入碱溶液时,OH-与
H+反应生成水,Al(OH)3的酸式电离平衡向正方向移动;Al(OH)3+OH-==[Al(OH)4]-
本题解析:
本题难度:一般
5、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:A项加入Na2SO4会使Ba2+的浓度减小;B项,蒸发时,Ba2+与S的浓度变化是一致的;D项,温度不变,Ksp不变。
本题难度:一般