1、选择题 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20mL 0.01mol/L KCl溶液②30mL 0.02mol/L CaCl2溶液③40mL 0.03mol/L HCl溶液④10mL 蒸馏水⑤50mL 0.05mol/L AgNO3溶液
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:B
本题解析:银离子和氯离子都抑制氯化银溶解,溶液中银离子或氯离子浓度越大,氯化银溶解度越小。①20mL 0.01mol/L KCl溶液中氯离子浓度为0.01mol/L,②30mL 0.02mol/L CaCl2溶液氯离子浓度为0.04mol/L,③40mL 0.03mol/L HCl溶液中氯离子浓度为0.03mol/L,④10mL 蒸馏水中可以认为氯离子或银离子浓度为0mol/L,⑤50mL 0.05mol/L AgNO3溶液中银离子浓度为0.05mol/L。所以氯化银溶解度由大到小的顺序为④①③②⑤。
点评:溶液中银离子或氯离子浓度越大,氯化银溶解度越小。
本题难度:一般
2、填空题 (12分)海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
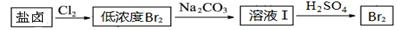
将Br2与Na2CO3反应的化学方程式补充完整:
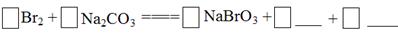
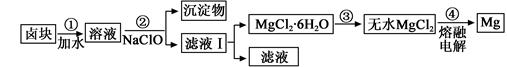
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(OH) 2
| 9.6
| 11.1
|
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
参考答案:(1)2Cl— +2H2O Cl2 ↑+H2↑+ 2OH—(2分)
Cl2 ↑+H2↑+ 2OH—(2分)
(2)3Br2 + 3Na2CO3 ="===" NaBrO3 + 5NaBr +3CO2(2分)
(3)①除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去(2分)
②ClO— +2Fe2+ +H2O + 4OH—====2Fe(OH)3 + Cl—或
ClO— +2Fe2+ +5H2O====2Fe(OH)3 + Cl— +4H+ (2分)
③Mg2+ +2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解。HCl还能带出水份,最终得到无水MgCl2 (2分)
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解。HCl还能带出水份,最终得到无水MgCl2 (2分)
④22.35(2分)
本题解析:(1)电解饱和食盐水生成氢气、氯气和氢氧化钠,离子方程式是2Cl—+2H2O Cl2↑+H2↑+ 2OH—。(2)Br2与Na2CO3反应生成溴化钠、溴酸钠和二氧化碳,化学方程式为3Br2 + 3Na2CO3 ="===" NaBrO3 + 5NaBr +3CO2;(3)①分析题给流程和信息知卤块加水溶解经步骤②加入次氯酸钠将其中的亚铁离子氧化为铁离子,控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去。②用NaClO 氧化Fe2+得到Fe(OH)3沉淀,本身被还原为氯化钠,离子反应方程式是ClO—+2Fe2+ +H2O + 4OH—====2Fe(OH)3 + Cl—或ClO— +2Fe2+ +5H2O====2Fe(OH)3 + Cl— +4H+。④步骤③需在HCl保护气中加热进行,原因是Mg2+ +2H2O
Cl2↑+H2↑+ 2OH—。(2)Br2与Na2CO3反应生成溴化钠、溴酸钠和二氧化碳,化学方程式为3Br2 + 3Na2CO3 ="===" NaBrO3 + 5NaBr +3CO2;(3)①分析题给流程和信息知卤块加水溶解经步骤②加入次氯酸钠将其中的亚铁离子氧化为铁离子,控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去。②用NaClO 氧化Fe2+得到Fe(OH)3沉淀,本身被还原为氯化钠,离子反应方程式是ClO—+2Fe2+ +H2O + 4OH—====2Fe(OH)3 + Cl—或ClO— +2Fe2+ +5H2O====2Fe(OH)3 + Cl— +4H+。④步骤③需在HCl保护气中加热进行,原因是Mg2+ +2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解 。HCl还能带出水份,最终得到无水MgCl2 。③NaClO与CO(NH2)2反应生成氯化钠、氮气、二氧化碳和水,该反应中氮元素的化合价由—3价升高到0价,氯元素的化合价由+1价降为—1价,根据电子守恒知参加反应的NaClO与CO(NH2)2的物质的量之比为3:1,除去0.1mol CO(NH2)2时消耗NaClO的物质的量为0.3mol,质量为22.35g。
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解 。HCl还能带出水份,最终得到无水MgCl2 。③NaClO与CO(NH2)2反应生成氯化钠、氮气、二氧化碳和水,该反应中氮元素的化合价由—3价升高到0价,氯元素的化合价由+1价降为—1价,根据电子守恒知参加反应的NaClO与CO(NH2)2的物质的量之比为3:1,除去0.1mol CO(NH2)2时消耗NaClO的物质的量为0.3mol,质量为22.35g。
考点:以海水的综合利用为载体考查离子方程式、化学方程式的书写,盐类水解原理的应用和氧化还原反应的计算。
本题难度:困难
3、填空题 已知:难溶电解质Cu(OH)2在常温下的Ksp=2×10-20,则常温下:
(1)某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
参考答案:(1)5?(2)6
本题解析:

本题难度:一般
4、选择题 已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
A.Ksp·Kh=Kw3
B.Ksp·Kw=Kh
C.Kh/Kw=Ksp
D.Kw/Kh=Ksp3
参考答案:A
本题解析:Ksp=c(Fe3+)·c(OH-)3,Kh=c3(H+)/c(Fe3+),则Ksp·Kh=c3(H+)·c3(OH-)=Kw3。答案选A。
本题难度:一般
5、选择题 在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
A.n(Ca2+)增大
B.c(Ca2+)不变
C.c(OH-)增大
D.n(OH-)不变