1、填空题 A、B、C、D四种可溶性化合物,分别由阳离子Na+、Al3+、Ba2+、Fe3+和阴离子Cl-、CO32-、OH-、SO42-中的各一种组成(离子不重复)。现做如下实验:
①A和B的溶液都显碱性,在A溶液中加入过量盐酸有无色气体产生;
②在C的溶液中加入KSCN溶液,溶液颜色发生变化;
③在D的溶液中加入B的溶液有白色沉淀生成,加入过量B的溶液,白色沉淀部分消失。
(1)根据以上实事推断化学式:A?,B? ?,C?,D?。
?,C?,D?。
(2)写出③的离子方程式?。
参考答案:(1)A:Na2CO3? B:Ba(OH)2? C:FeCl3? D:Al2(SO4)3(每空1分)
(2)Fe3++SCN-=〔Fe(SCN)〕2+(2分)
本题解析:略
本题难度:一般
2、填空题 如图所涉及的物质均为中学化学中的常见物质,其中C、D为非金属单质气体,E为金属单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
(1)写出有关物质的化学式:
F______,G______,H______.
(2)指出MnO2在相关反应中的作用,反应①中是______剂,反应②中是______剂.
(3)若反应①是在加热条件下进行,则A是______;若反应①是在常温条件下进行,则A是______.
(4)写出B与MnO2共热获得D的离子方程式:______.
(5)写出B与F反应的化学方程式______.
参考答案:与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3,则
(1)由以上分析可知,F为Fe3O4,G为FeCl2,H为FeCl3;故答案为:Fe3O4;FeCl2;FeCl3;
(2)在不加热条件下,用H2O2和MnO2制备O2,H2O2起到催化剂的作用,在加热条件下用浓盐酸和MnO2制备Cl2,发生:4HCl(浓)+MnO2?△?.?MnCl2+Cl2↑+2H2O,MnO2起到氧化剂的作用,故答案为:催化;氧化;
(3)反应①是在加热条件下进行,判断为实验室制氧气的反应,加热分解氯酸钾,2KClO3?△?.?2KCl+3O2↑,若常温下反应是二氧化锰催化剂分解过氧化氢,2H2O2?MnO2?.?2H2O+O2↑,
故答案为:KClO3;H2O2;
(4)B(HCl)与MnO2共热获得D(Cl2)的离子方程式为4H++2Cl-+MnO2?△?.?Mn2++Cl2↑+2H2O,
故答案为:4H++2Cl-+MnO2?△?.?Mn2++Cl2↑+2H2O;
(5)B(HCl)与F(Fe3O4)反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
本题解析:
本题难度:一般
3、填空题 非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸
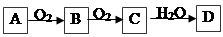
请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是??
②在工业生产中B气体的大量排放被雨水吸收后形成了?而污染了环境
(2)若A在常温下为气体,C是红棕色气体。①A和C的化学式分别是:A?;C?
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式?
参考答案:(1)①H2SO4?②酸雨?
(2)①N2? NO2?②Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2
本题解析:根据元素化合物知识分析,非金属单质可以实现上述转化的分别有C、S、N2, D为强酸,则不会是碳单质的转化;(1)①B是能使品红溶液褪色的被有刺激性气味的无色气体,B为SO2.所以据此推断C为SO3、D为H2SO4;②SO2被雨水吸收后生成H2SO3和H2SO4,即形成酸雨;(2)①A在常温下为气体,C是红棕色气体为NO2,A为N2;②据①可知D为硝酸,浓硝酸与铜反应生成NO2,答案为:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑.
本题难度:一般
4、填空题 下图为中学常见物质间的转化关系,其中甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,C常温下为无色液体,B焰色反应为黄色。一些在溶液中进行的反应溶液中的H2O及生成的H2O已省略。
回答下列问题:
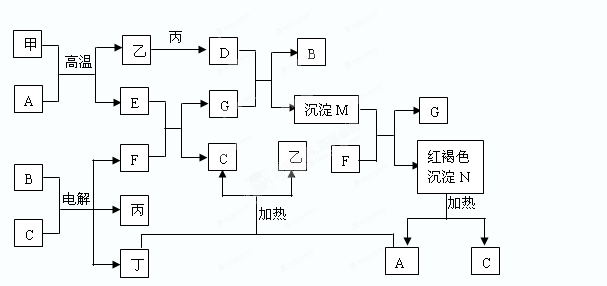
(1)单质乙所含元素在周期表中的位置______________________。
(2)化合物F的电子式________________________。
(3)D和G反应的离子方程式___________________________________。
(4)甲和A反应的化学方程式___________________________________。这类反应一般被称做________反应,该反应的主要应用_________________。(2种)
参考答案:(1)第四周期,Ⅷ族? (2分)? (写一半不给分)
(2)
(3)Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓? (2分)? (化学式1分,配平1分)
(4)2Al+Fe2O3  ?Al2O3+2Fe? (2分)? (无条件扣1分)?铝热 (2分) 焊接钢轨 冶炼难熔金属? (2分,每种1分)
?Al2O3+2Fe? (2分)? (无条件扣1分)?铝热 (2分) 焊接钢轨 冶炼难熔金属? (2分,每种1分)
本题解析:甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,甲为铝;C常温下为无色液体,C为水,N为红褐色固体,N为Fe(OH)3,Fe(OH)3受热分解生成氧化铁和水,则A为氧化铁,结合转化关系图及相关物质的性质,可推知,甲为铝,乙为铁,丙为氯气,丁为氢气,A为氧化铁,B为氯化钠, C为水,D为氯化铁,E为氧化铝,F为氢氧化钠,G为偏铝酸钠,M为氢氧化铝和氢氧化铁的混合物;(1)单质乙为铁,所含元素在周期表中的位置第四周期,Ⅷ族;(2)化合物F为氢氧化钠,电子式为?;(3)氯化铁溶液和偏铝酸钠溶液反应的离子方程式为Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓;(4)铝和氧化铁反应的化学方程式为2Al+Fe2O3 = Al2O3+2Fe ;这类反应一般被称做铝热反应,该反应的主要应用焊接钢轨 冶炼难熔金属。
本题难度:困难
5、简答题 A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子,结构特点如下表:
| 粒子代号 | A | B | C | D | E | F | G
原子核个数
单核
单核
双核
四核
单核
五核
五核
电荷数
0
1+
1-
0
2+
1+
0
|
请填写下列空白:
(1)A粒子的结构示意图为______、D粒子的电子式为______、G粒子的化学式为______;
(2)BC和EC2的碱性强弱为BC______EC2(填:>、<或=);
(3)加热条件下,F与C在溶液中反应的离子方程式为______.
参考答案:A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子.A为单核,电荷为0,则A为Ne原子;B为单核,电荷为+1,则B为Na+;C为双核,电荷为-1,则C为OH-;D为四核,电荷为0,则D为NH3;E为单核,电荷为+2,则E为 Mg2+;F为五核,电荷为+1,则F为NH4+;G为五核,电荷为0,则G为CH4.
(1)A为Ne原子,核外电子数为10,有2个电子层,最外层电子数为8,结构示意图为

;D为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为

;G粒子为CH4,故答案为:

;

;CH4;
?(2)BC为NaOH,EC2为Mg(OH)2,金属性Na>Mg,所以碱性NaOH>Mg(OH)2,故答案为:>;
(3)F为NH4+,C为OH-,加热条件下,NH4+与OH-在溶液中反应生成氨气与水,离子方程式为 NH4++OH-?△?.?NH3↑+H2O,
故答案为:NH4++OH-?△?.?NH3↑+H2O.
本题解析:
本题难度:一般