1、推断题 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
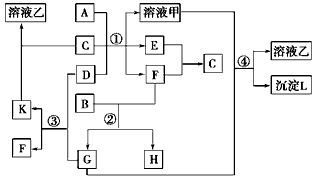
(1)A、B、C、D代表的物质分别为_______、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是__________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、_________(填化学式);
(4)反应③产物中K的化学式为__________________;
(5)反应④的离子方程式为___________________。
参考答案:(1)Al;C;H2O;Na2O2
(2)2Na2O2+2H2O==4NaOH+O2↑、2Al+2NaOH+6H2O==2Na[Al(OH)4]+3H2↑
(3)CO2;CO
(4)Na2CO3
(5)CO2+2[Al(OH)4]-+OH-+H2O==CO32-+Al(OH)3↓+H2O
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
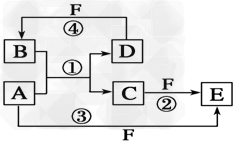
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则C的电子式为_________________,反应④的化学方程式为________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。请写出在水溶液中进行的反应②的离子方程式_______________;已知光照条件下D与F反应生成B,写出该反应的化学方程式:_________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_________________。
参考答案:(1)“略”;C+4HNO3(浓)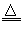 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)2Fe2++Cl2==2Fe3++2Cl-;H2+Cl2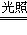 2HCl
2HCl
(3)2C+SiO2 Si+2CO↑
Si+2CO↑
本题解析:
本题难度:一般
3、填空题 下图是由一些常见元素组成的单质及其化合物之间的转化关系图。常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去)。请回答下列问题:

从反应②的实验现象可以得出物质C具有的某些物理性质有(写两点):?。
(2)J暴露在空气中的现象是?。
(3)①--⑦的反应中属于非氧化还原反应的有?。
(4)反应①的化学方程式为?。
(5)将115g甲酸(HCOOH)完全燃烧后的产物通过足量的固体A中,固体A将增重?g。
参考答案:
(1)银白色金属、固体、密度比水小、熔点低等(写到两点合理即可)
(2)白色固体迅速变成灰绿色,最后变成红褐色。?(3)③④⑥?
(4)2Na2O 2+2H2O=2NaOH+O2↑?(5)75
本题解析:A是有单质C在D中燃烧生成的淡黄色固体,淡黄色固体为Na2O2,则C为Na,D为O2,A为Na2O2,, D、F均为无色无味的气体,B是最常见的无色液体应为H2O,则E为NaOH,F为H2,,G是一种红褐色沉淀,是Fe (OH)3,H是FeCl3,I是FeCl2,J是Fe (OH)2。
(1)钠是银白色金属固体、密度比水小、熔点低等
(2)J是Fe (OH)2暴露在空气中易被氧化成Fe(OH)3,其现象是白色固体迅速变成灰绿色,最后变成红褐色。
(3)①--⑦中③④⑥属于非氧化还原反应。
(4)A为Na2O2,反应①是Na2O2与水的反应:2Na2O 2+2H2O=2NaOH+O2↑
(5)甲酸(HCOOH)的分子式CH2O2,燃烧后产物通过Na2O2,增重的质量就是其中含有的CO和H2的质量,增重=115g×30/46=75g
本题难度:一般
4、填空题 某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:① E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1。
②
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是?。(2)D→E反应的化学方程式是?。
(3)A→B反应所需的试剂是?。
(4)已知1 mol E 与2 mol J 反应生成1 mol M,则M的结构简式是?。
(5)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有?种,其中任意一种的结构简式是?
(6)J 可合成高分子化合物,该高分子化合物结构简式是?。
参考答案:1)羟基?
(2)HOOCCH2COOH+2CH3OH CH3OOCCH2COOCH3+2H2O
CH3OOCCH2COOCH3+2H2O
(3)NaOH水溶液
(4)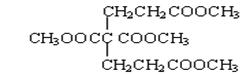
(5)5? HCOOCH2CH2CH2COOH、HCOOCH2CH(CH3)COOH、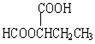 、
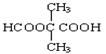
、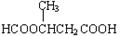 、
、 (任写一种即可)
(任写一种即可)
(6)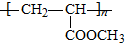
本题解析:A可以发生催化氧化,且氧化产物可以发生银镜反应,所以A中含有羟基。E的分子式为C5H8O4,能发生水解反应,所以E是酯类。核磁共振氢谱显示E分子内有2种不同环境的氢原子,且个数比为3:1,所以E的结构简式只能是CH3OOCCH2COOCH3。因为D中有羧基,所以D和甲醇酯化生成E,因此D的结构简式是HOOCCH2COOH,则C的结构简式是OHCCH2CHO,因此B的结构简式为HOC H2CH2CH2OH,所以A的结构简式是ClCH2CH2CH2OH,F是ClCH2CH2CHO,G是ClCH2CH2COOH。J是酯类,但可以形成高分子化合物,所以含有不饱和碳碳键,通过加聚反应生成高分子化合物,所以G生成H的反应应该是消去反应,即氯原子和邻位碳上的氢原子发生消去反应,所以H、J的结构简式分别为CH2=CHCOOH、CH2=CHCOOCH3。
(1)略
(2)D生成E属于酯化反应,方程式为
HOOCCH2COOH+2CH3OH CH3OOCCH2COOCH3+2H2O。
CH3OOCCH2COOCH3+2H2O。
(3)卤代烃的水解是在氢氧化钠的水溶液中进行的。
(4)根据已知②可知M的结构简式为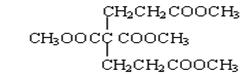 。
。
(5)能与NaHCO3反应生成CO2,说明含有羧基。能发生水解反应,且水解产物之一能发生银镜反应,说明是甲酸形成的酯,所以可能的同分异构体有HCOOCH2CH2CH2COOH、HCOOCH2CH(CH3)COOH、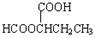 、
、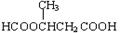 、
、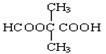 ,共5种。
,共5种。
(6)J 合成高分子化合物的反应是加聚反应,且产物结构简式为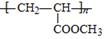 。
。
本题难度:一般
5、填空题 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题:

(1)A与B可反应,产物中阳离子的结构式为?。
(2)A与B的沸点比较,较高的是?(写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式:?。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式:?。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式:?。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于?处。若X为锌,开关K置于M处,该电化学防护法称为?。
参考答案:(1)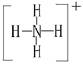 (2)NH3
(2)NH3
(3)2Fe3++2I- 2Fe2++I2
2Fe2++I2
(4)4NH3+5O2 4NO+6H2O
4NO+6H2O
(5)2Fe3++3Cl2+16OH- 2Fe
2Fe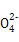 +6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH-
+6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH- 2Fe
2Fe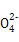 +6Cl-+8H2O]
+6Cl-+8H2O]
(6)N 牺牲阳极的阴极保护法
本题解析:根据图示和②乙在甲中燃烧发出苍白色火焰,则甲为Cl2,乙为H2,A为HCl。又因E的水溶液呈黄色,则E中应含Fe3+,即戊为Fe,E为FeCl3。又因丙、丁是空气的主要成分,即为N2和O2中的一种,再根据转化关系图,丁与戊(Fe)反应,故丁为O2,则丙为N2,B为NH3,C为NO,D为Fe2O3或Fe3O4。(1)A(HCl)与B(NH3)反应生成NH4Cl,N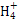 的结构式为
的结构式为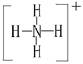 。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I-
。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I- 2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2
2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2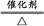 4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe
4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe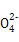 ,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH-
,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH- 2Fe
2Fe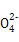 +6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH-
+6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH- 2Fe
2Fe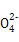 +6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
+6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
本题难度:一般