1、选择题 密闭容器中进行如下反应:N2O4(g)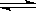 2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是?(?)
2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是?(?)
A.46
B.61.3
C.76.7
D. 69
参考答案:D
本题解析:N2O4转化率为33.3%即为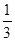 ,设有1mol N2O4进行N2O4(g)
,设有1mol N2O4进行N2O4(g)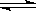 2NO2(g)反应,则反应平衡后,N2O4的物质的量为
2NO2(g)反应,则反应平衡后,N2O4的物质的量为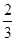 ?mol,NO2的物质的量为
?mol,NO2的物质的量为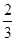 ?mol,即混合气体总物质的量为
?mol,即混合气体总物质的量为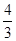 mol,则混合气体平均式量
mol,则混合气体平均式量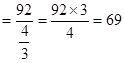
本题难度:一般
2、填空题 合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 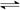 ?2NH3(g)?△H = -92 kJ·mol-1
?2NH3(g)?△H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
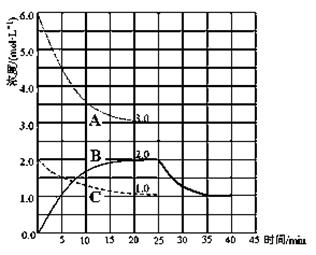
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是?(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是?。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ?(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将___?____(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ______?______。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ___?_____mol。
参考答案:(1)a c?(2)①C?②0.12 mol·L-1·min-1?③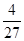 ?(或0.148、0.15); 减小
?(或0.148、0.15); 减小
(3)
说明:对曲线的曲率不做要求,但曲线弯的方向要考虑,这涉及到浓度对反应速率的影响问题。起点与终点要正确,达平衡的时间要一致。
(4)①60%?② 2
本题解析:(1)a.该反应随反应进行,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡, a正确;b.混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,错误。c.可逆反应到达平衡时,反应混合物各组分的浓度不发生变化,反应容器中N2的物质的量浓度不再发生变化,说明到达平衡,故c正确。d.单位时间内断开a个H-H键的同时形成3a个N-H键,都表示正反应速率,不能说明到达平衡,错误。e.反应混合物平衡时的浓度之比与起始浓度及转化率有关,平衡时可能等于化学计量数之比,也可能不等于,错误。
(2)①、N2是反应物,结合化学方程式分析,H2的曲线变化快,而N2的变化慢,所以表示N2的浓度变化的曲线是C。
②、根据v=△c÷t公式计算可得,前25 min 内,用H2的浓度变化表示的化学反应平均速率是0.12mol/(L·min) 。
③、平衡常数等于生应物的幂之积除以反应物的幂之积,故平衡常数K?=4/27。反应为放热反应,升高温度,反应逆向移动,故若升高温度,该反应的平衡常数值将减小。
(3)升高反应温度,平衡逆向移动,氢气的浓度增加1.5 mol·L-1,氨气减少1 mol·L-1,变为1.0mol·L-1画出曲线即可。
(4)设平衡时有x molN2转化?
N2(g)+3H2(g)) ?2NH3(g)
?2NH3(g)
起始物质的量:1mol? 3mol? 0
变化物质的量:x? 3x? 2x
平衡物质的量:1-x? 3-3x? 2x?
可得4-2x=2.8,得出x=0.6mol,α1?=60%;α1?+?α2?=1,说明这两个反应达到平衡时的状态完全相同,加入的氨气为2mol。
本题难度:困难
3、选择题 一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:
X(g)+3Y(g) 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是(?)
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是(?)
A.以X浓度变化表示的反应速率为1/8mol/(L·S)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的1/5
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0 ,升高温度,平衡常数K减小
参考答案:D
本题解析:生成0.6molZ,则消耗X是0.3mol,所以X的反应速率是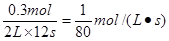 ,A不正确。容器容积扩大,则压强减小,平衡向逆反应方向移动,所以再次平衡时Z的平衡浓度小于原来的1/5,B不正确。增大X的浓度,平衡向正反应方向移动,所以物质Y的转化率增大,C不正确。反应放热,则升高温度平衡向逆反应方向移动,衡常数K减小,D正确,答案选D。
,A不正确。容器容积扩大,则压强减小,平衡向逆反应方向移动,所以再次平衡时Z的平衡浓度小于原来的1/5,B不正确。增大X的浓度,平衡向正反应方向移动,所以物质Y的转化率增大,C不正确。反应放热,则升高温度平衡向逆反应方向移动,衡常数K减小,D正确,答案选D。
本题难度:一般
4、填空题 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)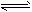 3C(g),已知加入1 molA和3molB且达到平衡后,生成了amol C。
3C(g),已知加入1 molA和3molB且达到平衡后,生成了amol C。
(1)达到平衡时,C在反应混合气体中物质的量分数为_______________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6molB,达到平衡后,C的物质的量为
________mol(用字母a表示)。此时C在反应混合气体中物质的量的分数_______________。(填“增大”、“减小”或“不变”)
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气体中体积分数不变,则还应加入C_____________mol。
参考答案:(1)25a%
(2)2a;不变
(3)6
本题解析:
本题难度:一般
5、选择题 哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3?。下列有关说法正确的是:
2NH3?。下列有关说法正确的是:
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
C.达到化学平衡时,反应则停止进行
D.当反应达到平衡时,每有3mol的H—H断裂,同时就有6mol的N—H键断裂。
参考答案:BD
本题解析:A.N2+3H2 2NH3反应是可逆反应,反应物可转化为生成物,生成物也可转化为反应物,所以反应物不能完全转化为生成物。错误。B.由于该反应是在体积恒定的密闭容器中发生的反应前后气体体积不等的反应。当反应达到化学平衡时,反应混合物中的任何成分N2、H2和NH3的物质的量浓度不再变化。正确。C.当反应达到化学平衡时,反应物还在反应产生生成物,生成物还在反应变为反应物,只是单位时间内任何物质消耗的浓度与产生的浓度相等,因此反应并未停止,任然在进行。错误。D.在任何时刻若有3mol的H—H断裂,就会有6mol的N—H键形成,同时有6mol的N—H键断裂。则相同的时间内N—H键形成与断裂数目相等,氨气的浓度不变,则反应达到平衡。正确。
2NH3反应是可逆反应,反应物可转化为生成物,生成物也可转化为反应物,所以反应物不能完全转化为生成物。错误。B.由于该反应是在体积恒定的密闭容器中发生的反应前后气体体积不等的反应。当反应达到化学平衡时,反应混合物中的任何成分N2、H2和NH3的物质的量浓度不再变化。正确。C.当反应达到化学平衡时,反应物还在反应产生生成物,生成物还在反应变为反应物,只是单位时间内任何物质消耗的浓度与产生的浓度相等,因此反应并未停止,任然在进行。错误。D.在任何时刻若有3mol的H—H断裂,就会有6mol的N—H键形成,同时有6mol的N—H键断裂。则相同的时间内N—H键形成与断裂数目相等,氨气的浓度不变,则反应达到平衡。正确。
本题难度:一般