1、填空题 (8分)在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g)?①?;
PH3(g) + HI(g)?①?;
4PH3(g)  ?P4(g)+ 6 H2(g)?②?;
?P4(g)+ 6 H2(g)?②?;
2HI(g) H2(g) + I2(g)?③
H2(g) + I2(g)?③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)=?,n(PH3)=?。
⑵ a,b,c三者的关系服从a >?(填含b,c的代数式)。
⑶平衡后,增大压强,容器内n(I2)?, n(PH4I)?(增加、减少、不变)
参考答案:(8分)(1)(d-c)/6? b+8/3c-2/3d? (2) b+2c? (3)?减少?增加
本题解析:由题知I2(气)为c mol,则HI分解生成的H2为c mol,PH3分解生成的H2为d mol- c mol,
生成的P4为(d-c)/6 mol,PH4I分解生成的HI、PH3均为2c mol+b mol,则a >2c mol+b mol,
PH3在第②个反应中消耗2(d-c)/3,则PH3剩下b+8/3c-2/3d。增大压强,①②两个反应均逆向移动,第③个反应加压平衡不移动但由于前2个反应均逆向移动,使其也逆向移动,即n(I2) 减少、n(PH4I)增加。
PH4I(S) PH3(g) +? HI(g) ①?; 4PH3(g)
PH3(g) +? HI(g) ①?; 4PH3(g) P4(g)+ 6 H2(g)②?;
P4(g)+ 6 H2(g)②?;
2c mol+b mol?2c mol+b mol? (d-c)/6?d mol- c mol
2HI(g) H2(g) + I2(g)?③?
H2(g) + I2(g)?③?
c mol? c mol
本题难度:一般
2、选择题 在一定温度下,向a L密闭容器中加入1mol X和2 mol Y,发生如下反应:X(s)+2Y(g) 2Z(g)此反应达到平衡的标志是?
2Z(g)此反应达到平衡的标志是?
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2
D.单位时间消耗0.1mol X同时生成0.2mol Z
参考答案:B
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以B正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,C不正确;根据方程式可知,反应前后气体体积是不变的,所以压强始终是不变的,A不正确;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,答案选B。
点评:判断化学平衡状态的标志? (1)任何情况下均可作为标志的:? ①υ正=υ逆(同一种物质)? ②各组分含量(百分含量、物质的量、质量)不随时间变化? ③某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数之比 (2)在一定条件下可作为标志的是 ①对于有色物质参加或生成的可逆反应体系,颜色不再变化。? ②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。? ③对于恒温绝热体系,体系的温度不在变化? (3)不能作为判断标志的是 ①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比。(任何情况下均适用)? ②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
本题难度:一般
3、计算题 加热时,N2O5可按下列分解:N2O5 ?N2O3 + O2,N2O3又可按下列分解:? N2O3
?N2O3 + O2,N2O3又可按下列分解:? N2O3 ?N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)=?mol/L,此时N2O5的分解率为?。
?N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)=?mol/L,此时N2O5的分解率为?。
参考答案:1.44mol/L? 76.5%
本题解析:根据元素守恒法可解。N2O5的起始浓度为? c(N2O5)=4mol/1L=4mol/L,
达平衡时的气体成份:N2O5? N2O3? N2O? O2
平衡浓度(mol/L)?设x? 1.62?设y? 4.5
由N原子守恒:2x+1.62×2+2y=2×4
由O原子守恒:5x+1.62×3+y+4.5×2=5×4
解得:x =" 0.94" mol/L,y =" 1.44" mol/L,所以,c(N2O)=" 1.44" mol/L,N2O5的分解率为:(4mol/L-0.94mol/L)/4mol/L×100%=76.5%
本题难度:一般
4、填空题 在一定温度下,在容积为2L 的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
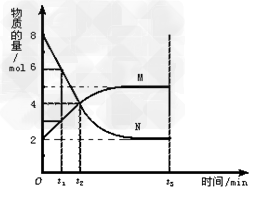
(1 )若t1=5S ,则前5S 用M 表示的反应速率为__________?。
(2 )t2时,正反应速率________(填“大于”“等于”或“小于”)逆反应速率。
(3 )下列说法正确的是________
A.t2时刻该反应达到平衡
B.t3时刻该反应达到平衡
C.反应开始时,生成物的浓度为0
D.该反应的限度是可以改变的
参考答案:(1 )0.1mol/(L·s)?
(2?)大于?
(3 )BD
本题解析:
本题难度:一般
5、选择题 在一定温度下,可逆反应A(g)+3B(g)  ?2C(g)达到平衡的标志是(?)
?2C(g)达到平衡的标志是(?)
A.A的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成nmolA,同时生成2nmolC
D.单位时间生成B的速率与生成C的速率相等
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。A、B中反应速率的方向相同,所以不能说明。C和D中反应速率的方向相反,但只有C中满足反应速率之比是相应的化学计量数之比,所以C正确,D不正确。答案选C。
本题难度:简单