1、选择题 有Fe2+、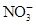 、Fe3+、
、Fe3+、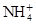 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(? )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(? )
A.氧化剂与还原剂的物质的量之比为8∶1
B.还原产物为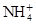
C.若有1 mol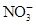 参加还原反应,转移8 mol e-
参加还原反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
参考答案:A
本题解析:分析各粒子的性质判断反应物和生成物,反应物应为Fe2+、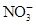 和H+,生成物应为Fe3+、
和H+,生成物应为Fe3+、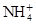 和H2O。运用得失电子守恒,配平方程式:8Fe2++
和H2O。运用得失电子守恒,配平方程式:8Fe2++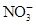 +10H+=8Fe3++
+10H+=8Fe3++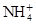 +3H2O,氧化剂
+3H2O,氧化剂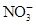 与还原剂Fe2+的物质的量之比为1∶8,A项错误;氧化剂
与还原剂Fe2+的物质的量之比为1∶8,A项错误;氧化剂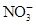 被还原得到还原产物
被还原得到还原产物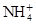 ,B项正确;若有1 mol
,B项正确;若有1 mol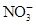 参加还原反应,则转移8 mol e-,C项正确;该氧化还原反应中氧化反应为Fe2+-e-=Fe3+,设计为原电池则为负极反应,D项正确
参加还原反应,则转移8 mol e-,C项正确;该氧化还原反应中氧化反应为Fe2+-e-=Fe3+,设计为原电池则为负极反应,D项正确
本题难度:一般
2、简答题 I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是______.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10?10C+P4O10═P4+10CO
每生成1mol?P4时,就有______mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I-?2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a?mol?L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b?mol?L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是______mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol?L-1
KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1
Na2SO3溶液的体积/mL | H2O的体积
/mL | 实验
温度
/℃ | 溶液出现蓝色时所需时间/s
实验1
5
V1
35
25
实验2
5
5
40
25
实验3
5
5
V2
0
|
该实验的目的是______;表中V2=______mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(5)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是______.
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:______Ce3++______H2O2+______H2O═______Ce(OH)4↓+______.
参考答案:(1)P属于第15号元素,其原子的结构示意图为

,故答案为:

;
(2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4 mol=20 mol或C化合价由0价变成为+2价,电子转移为2×10 mol=20 mol,故答案为:20;
(3)I2溶液一部分与硫代硫酸钠反应,一部分与维生素C反应,n(Na2S2O3)=bV21000mol;
与其反应的碘单质为 bV22000mol,与维生素C反应的碘单质为 2aV1-bV22000mol,
即维生素C的物质的量是 2aV1-bV22000=aV1-0.5bV21000;
故答案为:2aV1-bV22000;
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:目的是探究该反应速率与亚硫酸钠浓度,反应温度的关系,V2=40?mL;
(5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可知NH4Cl的作用是分解出HCl气体,抑制CeCl3水解,
故答案为:分解出HCl气体,抑制CeCl3的水解;
(6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2;1;6;2;6H+.
本题解析:
本题难度:一般
3、选择题 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是
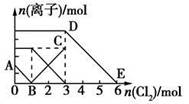
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2
参考答案:D
本题解析:本题考查了化学图像、元素化合物的性质、氧化还原反应、化学计算等,意在考查考生的识图能力及计算能力。还原性顺序:Br-<Fe2+<I-,根据化学图像、反应原理知,线段AB代表I-物质的量的变化情况,线段BC代表Fe3+物质的量的变化情况,线段DE代表Br-物质的量的变化情况,A项正确;根据图像中消耗氯气的量可知,原溶液中n(I-)=2 mol,n(Fe2+)=4 mol,n(Br-)=6 mol,n(Fe2+):n(I-):n(Br-)=2:1:3,D项错误;n(FeBr2)=3 mol,n(FeI2)=1 mol,B项正确;当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-,C项正确。
本题难度:一般
4、选择题 硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是(?)
A.1:3
B.2:3
C.1:1
D.4:3
参考答案:B
本题解析:3(NH4)2SO4 4NH3↑+3SO2↑+N2↑+6H2O
4NH3↑+3SO2↑+N2↑+6H2O
因此生成的氧化产物N2和还原产物SO2的物质的量之比是1:3,选A。
本题难度:一般
5、计算题 (5分)氧化锌和锌的混合物14.6 g,加入浓度为1 mol/L的盐酸500 mL,充分反应后,所得溶液中Zn2+的物质的量浓度为0.4 mol/L,求原混合物中氧化锌和锌的物质的量。(假设反应前后溶液体积不变)
参考答案:(5分)n(Zn)="n" (ZnO)="0.1" mol
本题解析:略
本题难度:简单