1、简答题 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质.测定过氧化的含量.请填写下列空白:
(1)移取10.00mL密度为ρg/mL的过氧化氢溶液至250mL______(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里.
______MnO4+______H2O2+______H+═______Mn2++______H2O+____________
(3)滴定时,将高锰酸钾标准溶液注入______(填“酸式”或“碱式”)滴定管中.滴定到达终点的现象是______.
(4)重复滴定三次,平均耗用c?mol/L?KMnO4标准溶液V?mL,则原过氧化氢溶液中过氧化氢的质量分数为______.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果______(填“偏高”或“偏低”或“不变”).
参考答案:(1)准确配制一定体积一定物质的量浓的溶液用容量瓶,故答案为:容量瓶;
(2)方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,先确定缺的是O2,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,答案为:2、5、6、2、8、502;
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,故答案为:酸式;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;
(4)根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用c?mol/L?KMnO4标准溶液V?mL,即cV×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5cV×10-3mol,则原过氧化氢的质量为:0.025cVmol×34g/mol=0.85cV,过氧化氢溶液中过氧化氢的质量分数为:,0.85cV10.00mL×ρg/mL=0.085cVρ,故答案为:0.085cVρ;
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高.
本题解析:
本题难度:一般
2、选择题 工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C.Na2Cr2O7中Cr元素的化合价为+7
D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子
参考答案:B
本题解析:反应②中元素无化合价的变化,A项错误;Na2Cr2O7中Cr的化合价为+6价,C项错误;从反应①看该反应转移电子数为28 mol,故生成1 mol Na2CrO4转移电子数为3.5 mol,D项错误。
本题难度:一般
3、选择题 a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质的量之比为
A.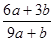
B.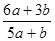
C.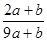
D.不能确定
参考答案:A
本题解析:该反应中元素的化合价变化为:S元素化合价由-2价变为+6价,失去8个电子。Fe元素化合价由+2价变为+3价,失去1个电子。N元素化合价由+5价变为+2价,得到3个电子。所以反应中氧化产物是Fe(NO3)3和H2SO4,还原产物是NO。设生成NO的物质的量为x,根据电子得失守恒可知,a×[6-(-2)+(3-2)]mol+b×(3-2)mol=(5-2)×x,解得x=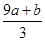 mol。根据原子守恒知,氧化产物的物质的量=(a+b)mol+amol=(2a+b)mol,所以氧化产物和还原产物的物质的量之比=
mol。根据原子守恒知,氧化产物的物质的量=(a+b)mol+amol=(2a+b)mol,所以氧化产物和还原产物的物质的量之比=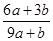 ,答案选A。
,答案选A。
本题难度:一般
4、填空题 在放电条件下,氮气与氧气可直接化合:N2+O2 2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
参考答案:(4分,每空2分)? O2? 4
本题解析:根据方程式可知,氮气中氮元素的化合价从0价升高到+2价,失去电子,做还原剂。氧气中氧元素的化合价从0价降低到-2价,得到电子,氧气是氧化剂。若反应中消耗了1 mol N2,则转移4mol电子。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。该题的关键是准确判断出有关元素的化合价变化情况,然后依据题意灵活运用即可。
本题难度:一般
5、选择题 干燥剂的干燥性能可用干燥效率(1 m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下

根据以上数据,下列有关叙述错误的是
[? ]
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
参考答案:D
本题解析:
本题难度:一般