1、简答题 实验室用Na2SO4?10H2O配制0.1mol/L的Na2SO4溶液500ml.有以下仪器:
①药匙?②100ml量筒?③1000ml容量瓶?④锥形瓶?⑤玻璃棒?⑥烧杯
(1)配制时,必须选用的仪器为:______(填代号),还缺少的玻璃仪器为______
(2)经计算,本实验需称量硫酸钠晶体(Na2SO4?10H2O)为______g.
(3)用Na2SO4?10H2O配制标准溶液的正确顺序是______.
A.冷却?B.称量?C.洗涤?D.定容?E.溶解?F.摇匀?G.移液
(4)将所配制的Na2SO4溶液进行测定,发现浓度大于0.1mol/L.请你分析配制过程中可能引起该误差的原因是(填字母代号)______
①容量瓶不干燥,含有少量蒸馏水?②定容时俯视刻度线?③定容时仰视刻度线?④未冷却至室温就转移到容量瓶中?⑤没有洗涤烧杯和玻璃棒.
参考答案:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以需要的仪器有托盘天平、烧杯、玻璃棒、500ml的容量瓶、胶头滴管、药匙、量筒(可用可不用),
故必须选用的仪器为:①⑤⑥,还缺少的玻璃仪器为:500ml的容量瓶、胶头滴管,
故答案为:①⑤⑥,500ml的容量瓶、胶头滴管;
(2)硫酸钠的物质的量为0.5L×0.1mol?L-1=0.05mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,故需要硫酸钠晶体的质量为0.05mol×322g/mol=16.1g,
故答案为:16.1;
(3)由(1)溶液配制操作可知,正确顺序是BEAGCGDF,
故答案为:BEAGCGDF;
(4)①最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故不符合;
②定容时,俯视容量瓶刻度线,液面在刻度线以下,使溶液的体积偏小,所配溶液浓度偏高,故符合;
③定容时仰视刻度线,液面在刻度线以上,溶液体积偏大,所配溶液浓度偏低,故不符合;
④未冷却至室温就转移到容量瓶中定容,溶液冷却后,使溶液的体积偏小,所配溶液浓度偏高,故符合;
⑤没有洗涤烧杯和玻璃棒,少量硫酸钠沾在烧杯壁与玻璃棒上(洗涤液中含有少量硫酸钠),移入容量瓶中硫酸钠的实际物质的量减小,溶液浓度偏低,故不符合;
故选②④.
本题解析:
本题难度:一般
2、填空题 483g Na2SO4·10H2O中所含的Na+的物质的量是 和SO42—的物质的量是 ,所含H2O分子的数目是 个。
参考答案:3mol 1.5mol 15NA
本题解析:略
本题难度:一般
3、选择题 下列关于0.05mol /L的K2SO4溶液的说法中,正确的是
A.1L溶液中含有K+、SO42-总数为0.03NA
B.1L溶液中含有K+数目是0.1NA
C.1 L溶液中K+的浓度是0.20 mol / L
D.2 L溶液中含有SO42-的浓度是0.3mol / L
参考答案:B
本题解析:在0.05mol /L的K2SO4溶液中K+的浓度是0.10 mol / L、SO42-的浓度是0.05mol / L,而与溶液体积无关,排除CD选项;在1L的0.05mol /L的K2SO4溶液中,K+数目为0.05×2×1×NA=0.1NA,SO42-个数为0.05NA,两者总数为0.15NA,故答案为B
本题难度:一般
4、选择题 设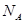 表示阿伏加德罗常数,下列叙述中正确的是?
表示阿伏加德罗常数,下列叙述中正确的是?
①.31g白磷含有的P—P键数为NA?
②. 1mol CH3+(碳正离子)中含有电子数为10NA?
③. 1mol铜与足量硫蒸气反应,转移电子数为2NA?
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子?
⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA?
⑥.0.84 g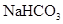 晶体中阳离子和阴离子总数为0.03NA?
晶体中阳离子和阴离子总数为0.03NA?
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA?
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA?
⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023?
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧? B ③④⑥⑦⑧? C ④⑦? D④⑥⑨⑩
参考答案:C
本题解析:①在一个白磷P4分子中含有6个P—P共价键,所以.31g白磷含有的P—P键数为31g ÷(31×4)g/mol×NA=1.5NA.错误. ②. 1molCH3+(碳正离子)中含有电子数为9NA .错误. ③由于S的氧化性弱,在与Cu反应时1个S只能得到1个电子,所以 1mol铜与足量硫蒸气反应,转移电子数为NA。错误。④Mg是+2价的金属,因此1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子。正确。⑤.用惰性电极电解CuCl2溶液,实质就是电解CuCl2本身。若阴极析出16g铜时,n(Cu)=16g÷64g/mol=0.25mol,Cu是+2价的金属,所以线路中通过的电子是0. 5mol,即电子数为0. 5NA。错误。⑥电离方程式为NaHCO3=Na++HCO3-,0.84 g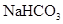 的物质的量0.01mol,所以在晶体中阳离子和阴离子总数为0.02NA.错误。⑦3.9gNa2O2的物质的量为0.05mol,每有1mol的Na2O2吸收足量的CO2时转移电子1mol,所以0.05mol的Na2O2反应转移的电子数是0.05NA。正确。⑧反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.若有1mold Cu反应,产生NO21mol。n(Cu)=3.2g÷64g/mol=0.05mol,所以在标准状况下,3.2g铜Cu与足量的浓硝酸反应生成的气体含有的分子数是0.05NA.错误。⑨C16O相对分子质量是28,28 g C16O的物质的量为1mol,含有质子数是14×6.02×1023?;C18O相对分子质量是30,28 g C18O中含有的质子的物质的量小于1mol,因此含有的质子数小于14×6.02×1023。错误。⑩.标准状况下,22.4 L氯气的物质的量为1mol,反应方程式为 Cl2+2NaOH=NaCl+NaClO+H2O。所以1mol的氯气与足量氢氧化钠溶液反应转移的电子数为1×6.02×1023 .错误。因此正确的说法是④⑦,选项为C。
的物质的量0.01mol,所以在晶体中阳离子和阴离子总数为0.02NA.错误。⑦3.9gNa2O2的物质的量为0.05mol,每有1mol的Na2O2吸收足量的CO2时转移电子1mol,所以0.05mol的Na2O2反应转移的电子数是0.05NA。正确。⑧反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.若有1mold Cu反应,产生NO21mol。n(Cu)=3.2g÷64g/mol=0.05mol,所以在标准状况下,3.2g铜Cu与足量的浓硝酸反应生成的气体含有的分子数是0.05NA.错误。⑨C16O相对分子质量是28,28 g C16O的物质的量为1mol,含有质子数是14×6.02×1023?;C18O相对分子质量是30,28 g C18O中含有的质子的物质的量小于1mol,因此含有的质子数小于14×6.02×1023。错误。⑩.标准状况下,22.4 L氯气的物质的量为1mol,反应方程式为 Cl2+2NaOH=NaCl+NaClO+H2O。所以1mol的氯气与足量氢氧化钠溶液反应转移的电子数为1×6.02×1023 .错误。因此正确的说法是④⑦,选项为C。
本题难度:一般
5、实验题 (15分)实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,回答下列问题:
(1)请简要叙述该实验的主要实验步骤:
①__________________;②__________________;
③__________________;④__________________;
⑤__________________;⑥__________________。
(2)所需仪器为:容量瓶(规格为________)、托盘天平,还需要哪些实验仪器才能完成该实验,请写出:_________________________________________
(3)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有_______________;偏小的有 ;无影响的有 。
A.称量时使用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶中移液时,有少量液体溅出