1、选择题 下列叙述不正确的是
A.NaOH的碱性介于KOH和Mg(OH)2之间
B.Li、Na、K、Rb元素金属性依次增强
C.Na+、Mg2+、Al3+的离子半径依次增大
D.H2SiO3、H2CO3、HClO4酸性依次增强
参考答案:C
本题解析:
答案:C
A、正确,金属性K>Na>Mg, NaOH的碱性介于KOH和Mg(OH)2之间;B.正确,Li、Na、K、Rb原子半径依次增大,元素金属性依次增强;C、不正确,核外电子层结构相同时,核电荷数大,半径反而小,Na+、Mg2+、Al3+的离子半径依次减小;D.正确,非金属性Si <C<Cl,H2SiO3、H2CO3、HClO4酸性依次增强。
本题难度:一般
2、选择题 做实验要注意安全.若用混入碳粉的二氧化锰与氯酸钾混合加热制取氧气会发生爆炸,因此在实验前要除去混在二氧化锰中的碳粉,其方法是将混入碳粉的二氧化锰
A.加热到碳粉烧尽
B.用水溶解、过滤、除去碳粉
C.用水溶解,再蒸馏除去碳粉
D.用NaOH溶液溶解碳粉
参考答案:A
本题解析:用燃烧法除C将其转化成CO2.
本题难度:困难
3、选择题 已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应水化物酸性依次增强,则下列判断正确的是 (? )
A.最高化合价按X、Y、Z的顺序减小
B.阴离子的还原性按X、Y、Z顺序增强
C.单质的氧化性按X、Y、Z顺序增强
D.氢化物的稳定性按X、Y、Z顺序减小
参考答案:
C
本题解析:略
本题难度:简单
4、选择题 已知氢有3种核素: ,氯有2种核素:
,氯有2种核素: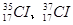 ,则HCl分子的相对分子质量数值可能有几种
,则HCl分子的相对分子质量数值可能有几种
A.1种
B.5种
C.6种
D.1000种
参考答案:B
本题解析:根据排列组合可知,HCl的相对分子质量的数值可以是36、37、38、39、40,答案选B。
本题难度:一般
5、简答题 (12分)A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大。A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y, 且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子, 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为?___________。
参考答案:(1)氮;N≡N (2)Na·+·H→Na+[:H]-
(3)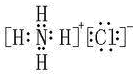 ;?
;?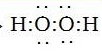 (4)Al(OH)3+OH-=AlO2-+2H2O
(4)Al(OH)3+OH-=AlO2-+2H2O
本题解析:根据题意可推知这几种元素分别是A是H;B是N;C是O;D是Na;E是Al;F是Cl。(1)B元素的名称是氮;B单质的结构式为N≡N。(2)用电子式表示化合物X的形成过程为Na·+·H→Na+[:H]-。(3)化合物NH4Cl的电子式为为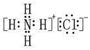 。Na2O2的电子式为
。Na2O2的电子式为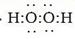 。(4)Na的最高价氧化物的水化物NaOH是强碱;、Al最高价氧化物的水化物Al(OH)3是两性氢氧化物,能跟强碱发生反应,生成盐和水。该反应的两种方程式为Al(OH)3+OH-=AlO2-+2H2O。
。(4)Na的最高价氧化物的水化物NaOH是强碱;、Al最高价氧化物的水化物Al(OH)3是两性氢氧化物,能跟强碱发生反应,生成盐和水。该反应的两种方程式为Al(OH)3+OH-=AlO2-+2H2O。
本题难度:一般