1、选择题 下列电子层中,原子轨道的数目为4的是 (?)
A.K层
B.L层
C.M层
D.N层
2、填空题 (5分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式?▲?;
(2)Be(OH)2与Mg(OH)2可用__▲___试剂鉴别,其反应离子方程式为?▲?。
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是__▲____;同时还有少量??▲?生成。
3、填空题 下表为周期表前20号元素中某些元素的有关数据:
元素性质
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
| ⑨
| ⑩
|
原子半径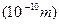
| 1.86
| 1.52
| 0.66
| 1.43
| 0.77
| 1.10
| 0.99
| 2.31
| 0.70
| 0.64
|
最高价态
| +1
| +1
| ——
| +3
| +4
| +5
| +7
| +1
| +5
| ——
|
最低价态
| ——
| ——
| -2
| ——
| -4
| -3
| -1
| ——
| -3
| -1
|
试回答下列问题:(以下各题回答,可能的话,均用对应的元素符号或物质的化学式表示)
(1)写出⑦⑨与氢元素形成的常见离子化合物的电子式?
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最
外层为8电子稳定结构的物质可能是?、?;
(3)某元素R的原子半径为1.04× m,该元素在周期表中的位置是?
m,该元素在周期表中的位置是?
(4)以上10种元素的原子中,失去核外第一个电子所需能量最少的是?
(5)④、⑦、⑧、⑩四种元素形成的离子,其半径由小到大的顺序为?
4、选择题 下列物质,从化学组成的角度看,属于纯净物的是
A.某物质经检验只含有一种元素
B.不含杂质的无色透明的食盐水
C.浓硫酸
D.0℃时的冰水混合物
5、填空题 (12分)空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为?。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
① 写出亚铁离子的基态电子排布式?。
② CO有多种等电子体,其中常见的两种为?。
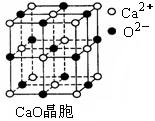
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在
燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位
数为?,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分
别为:CaO-3?401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点?NaCl
晶体的熔点(填“高于”、“等于”或“低于”)。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是:?。