1、实验题 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。
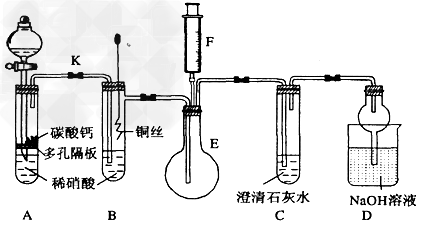
请回答有关问题:
(1)?设计装置A的目的是___________________;为达到此目的,应进行的操作是打开K,且打开分液漏斗活塞,当装置C中产生______________时,关闭K。
(2)?在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是______________; B中反应的离子方程式为:________________________。
(3)?装置E和F的作用是________________;为实现此作用,其操作方法是_____________________________。
(4)?装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有________________的功能。
参考答案:(1)利用生成的二氧化碳将整个装置内的空气赶尽,避免NO和氧气反应生成二氧化氮对气体产物的观察产生干扰;白色沉淀
(2)铜丝表面产生气泡,稀硝酸液面上仍为无色,溶液变为蓝色;3Cu+8H++2NO3-=3Cu2++
2NO↑+4H2O
(3)验证无色气体为NO;将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中
(4)防止溶液倒流
本题解析:
本题难度:一般
2、填空题 类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3、,但当铁过量时,产物是 Fe ( NO3 ) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
( 1 )提出假设: A 是 FeCl3, B 是 FeCl 2。
( 2 )设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。

( 3 )根据上述实验结论,写出 C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
( 4 )为进一步探究 FeC13溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____________________。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13固体
( 5 )实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加人适量的盐酸调节溶液的 pH =" 1" ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________________
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
参考答案:(2)溶液变红色(1分) FeCl2 ( 1 分) ( 3 ) 2Fe十3Cl2 2FeCl3 ( l 分)
2FeCl3 ( l 分)
( 4 ) BD (2分) ( 5 )方案 1 : Fe3+ >Cu2+ > H + > Fe2+ ( l 分)
方案 2 :阴( l 分)2Fe 3++2e一=2Fe2+ ;
Cu2+ + 2e一=Cu ( l 分);
2H + + 2e一=H2↑; ( l 分)
①污染性气体 C12产生( l 分)②使用了电解装置,成本较高等。( l 分)
本题解析:Fe3+遇SCN一变红色。 Fe2+能使 KMnO4溶液褪色; FeC13溶液加人铁粉,将三价铁还原为二价铁,颜色变浅; FeC13溶液加热蒸干最后得到的是三氧化二铁, ( 5 )向废液中加人过量的铁粉,铁粉首先和三价铁离子反应,将其转化为二价铁离子,然后和铜离子反应,再加人盐酸,盐酸和过量的铁粉反应生成二价铁离子,由此知四种离子的氧化性由强到弱的顺序为Fe3+ >Cu2+ > H+ >Fe2+,方案 2 中用铜作阴极,电极上的反应为2Fe3++2e一=2Fe2+,然后 Cu2++2e一=Cu , 2H+十2e一=H 2↑ , 不足之处,阳极会产生氯气污染,会消耗大量的电能等。
本题难度:一般
3、实验题 (15分)从固体混合物A出发可以发生如下框图所示的一系列变化。

(1)在实验室,气体C的检验方法是??。 ? (2)操作②的名称是 ?,该操作所使用的玻璃仪器有?。
(3)写出下列反应的离子方程式:
反应③ ??;
反应④ ??。
(4)实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是??(填序号)。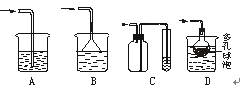
参考答案:

本题解析:略
本题难度:简单
4、简答题 某研究性学习小组将实验室制备二氧化碳气体反应后的废物进行处理,目的是制取中性干燥剂CaCl2.得到固体后,他们对固体的成分进行了如下探究:
[提出猜想]
猜想一:只有CaCl2
猜想二:CaCl2和CaCO3
猜想三:CaCl2和HCl
通过讨论,大家认为“猜想三”不成立,理由是______.
[实验探究]
| 操作 | 现象 | 结论
步骤一
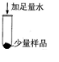
______ |
猜想二成立
步骤二

______
|
(1)写出有关反应的化学方程式:______
(2)实验结束后,同学们根据复分解反应发生的条件,总结出得到CaCl2的不同途径,如:
①Ca(OH)2+YCla﹦CaCl2+Z↓,那么Z可能是______(填一种物质的化学式即可);
②CaXm+2YClb﹦CaCl2+H2O,则“YClb”属于______类物质.
(3)同学们又用类比的方法对CaCl2可能具有的化学性质进行了探究,总结出其能与下列物质中的______发生反应(填编号).
①HNO3?②AgNO3?③Na2CO3?④Fe(OH)3?⑤Mg?⑥BaCO3.
参考答案:[提出猜想]得到固体后,他们对固体的成分进行了探究,做出的猜想中,“猜想三”不成立,理由是CaCl2是固体,氯化氢气体溶于水是盐酸,盐酸是液体,
故答案为:CaCl2是固体,盐酸是液体(CaCl2是固体、盐酸是液体、盐酸易挥发;合理即可);
[实验探究]探究对象是固体,而猜想三中的HCl是气体;根据碳酸钙不溶于水,样品溶于水,固体部分溶解,与稀盐酸反应有气泡冒出,可以判断碳酸钙是否存在,故答案为:
操作现象实验结论步骤一固体部分溶解步骤二固体溶解,产生气泡(1)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平后的反应为CaCO3+2HCl=CaCl2+CO2↑+H2O,故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)根据复分解反应发生的条件,总结出得到CaCl2的不同途径,即碱和盐反应生成新碱和新盐,因此Z可能是Cu(OH)2、Fe(OH)3、Mg(OH)2、Zn(OH)2、Al(OH)3、Fe(OH)2等难溶性碱;碱和酸或金属氧化物与酸反应生成盐和水,因此“YCln”属于酸,
故答案为:①Cu(OH)2[Fe(OH)3、Mg(OH)2、Zn(OH)2、Al(OH)3、Fe(OH)2等难溶性碱;②酸;
(3)①氯化钙和硝酸不反应,①不符合;
②AgNO3 氯化钙和硝酸银反应生成氯化银沉淀,故②符合;
③Na2CO3与 氯化钙反应生成碳酸钙沉淀,故③符合;
④Fe(OH)3 与氯化钙不反应,故④不符合;
⑤Mg不与氯化钙反应,故⑤不符合;
⑥BaCO3不与氯化钙反应,故⑥不符合;
故答案为:②③.
本题解析:
本题难度:一般
5、填空题 某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:N a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
根据图中装置和反应现象请回答:
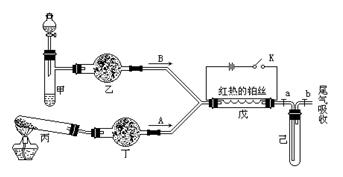
(1)丙中发生反应的化学方程式为?。
(2)丁中的干燥剂应选?,不选另一种干燥剂的理由是?。
(3)甲中发生反应的化学方程式为? ?。
?。
(4)戊中发生的主要反应的化学方程式为?,此反应是(吸热、放热)?反应,可能发生的什么现象可以证明你的判断?。
参考答案:(1)NH4HCO3 NH3↑+CO2↑+H2O↑(2分)
NH3↑+CO2↑+H2O↑(2分)
(2)碱石灰(1分);无水CaCl2只能吸水,不能吸收CO2,且NH3要与无水CaCl2反应( 1分)
(3)2H2O2 2H2O+O2↑(或2Na2O2+2H2O
2H2O+O2↑(或2Na2O2+2H2O 4NaOH+O2↑)(2分)
4NaOH+O2↑)(2分)
(4)4NH3+5O2 4NO+6H2O(2分);放热(1分);反应开始后断开电键K,铂丝能继续保持红热(1分)。
4NO+6H2O(2分);放热(1分);反应开始后断开电键K,铂丝能继续保持红热(1分)。
本题解析:略
本题难度:一般