1、选择题 能够用来鉴别BaCl2、KOH、Na2CO3三种物质的试剂是( )
A.AgNO3溶液
B.稀硫酸
C.稀盐酸
D.稀硝酸
参考答案:A.BaCl2、Na2CO3均与AgNO3溶液反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.BaCl2、KOH、Na2CO3三种物质分别与稀硫酸反应的现象为:白色沉淀、无现象、生成无色气体,现象不同,可鉴别,故B正确;
C.BaCl2、KOH与稀盐酸混合,现象相同,不能鉴别,故C错误;
D.BaCl2、KOH与稀硝酸混合,现象相同,不能鉴别,故D错误;
故选B.
本题解析:
本题难度:一般
2、实验题 为了探究铁与氯气在一定条件下反应后的固体中铁元素的价态,化学兴趣小组的甲、乙、丙三同学分别进行了如下实验。
(1)甲取少许反应后的固体,加入适量稀硝酸,在所得溶液中滴加KSCN溶液出现血红色,则此时溶液显血红色的离子方程式为_______________________________________。该同学由此得出铁与氯气的反应产物中含有+3价铁的结论。请指出该结论是否合理并说明理由_________________________________________________________。
(2)乙取少许反应后的固体,加入盐酸,溶解、过滤,向滤液中滴加KSCN溶液,溶液呈无色。乙由此得出铁与氯气的反应产物中含有+2价铁的结论。请指出该结论是否合理并说明理由
____________________________________________________________。
(3)丙取11.2g铁粉与氯气反应,将反应后所得固体研碎分成两等份,其中一份用磁铁吸引,吸出的固体质量为1.4g;另一份用水完全溶解后加入足量的硝酸银溶液,所得白色沉淀经洗涤干燥后称重为32.29g。根据以上数据确定反应产物中铁元素的价态是____________(写出计算和推理过程)。
参考答案:(1)Fe3+ + 3SCN- = Fe(SCN)3?不合理。稀硝酸有强氧化性,若铁为+2价,则被氧化为+3价同样可使溶液变成血红色
(2)不合理。若铁为+3价、铁粉过量,则过量的铁可以将Fe3+还原成Fe2+
(3)+3。因n(Fe) = (5.6-1.4) /56 =" 0.075" mol,n(Cl) =" 32.29/143.5" =" 0.225" mol,所以n(Fe) / n(Cl) =" 1/3" ,则反应产物中只有+3价铁
本题解析:略
本题难度:简单
3、实验题 下图是某同学设计的探究反应热效应的观察装置。其操作顺序是:
①按下图所示将实验装置连接好;
②在U形管内加入少量红墨水溶液(或品红)。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛有1g氧化钙,当滴入2mL左右的蒸馏水后,即可观察。试回答
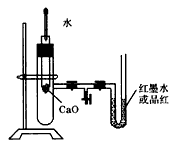
(1)实验中观察到的现象是_____________。
(2)该实验中必须进行的一步实验操作是_______________。
(3)该实验的原理是_______________。
(4)实验中进行的化学方程式是_______________。
(5)该实验表明CaO和H2O的能量与Ca(OH)2的能量之间的关系为_______________。
参考答案:(1)U形玻璃管里的红墨水左侧液面下降,而右侧开口端液面上升
(2)检查装置的气密性
(3)CaO与水反应放出热量,使大试管中的空气受热膨胀,压强变大,引起红墨水在U形管中的位置不再相平
(4)CaO+H2O=Ca(OH)2
(5)CaO和H2O的能量和大于Ca(OH)2的能量
本题解析:
本题难度:一般
4、实验题 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
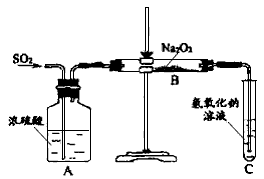
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:_____________
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
_________________________________
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有
Na2SO4生成,他们设计了如下方案:

上述方案是否合理?___________。请简要说明两点理由:①______________;②_____________。
参考答案:(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体
(3)不合理;稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
本题解析:
本题难度:一般
5、实验题 (16分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
?。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:?。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量?
(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如以下流程图所示:
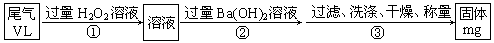
(4)写出步骤②中反应的化学方程式?。
(5)步骤③中洗涤沉淀的方法是?。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为?(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
?。
参考答案:(1)增大气体与溶液的接触面积,有利于SO2与碘水充分反应(2分)
(2)酸性高锰酸钾溶液等(2分)
(3)偏低(2分)
(4)H2SO4+Ba(OH)2==BaSO4↓+2H2O(3分)
(5)向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次? (2分)
(6)22.4m / (233V)(3分)
(7)不合理。BaSO3被部分氧化为BaSO4(2分)
本题解析:甲.(1)根据多孔球泡D的结构可知可以增大反应物的接触面积,使反应更充分。
(2)SO2具有还原性,还是一种酸性氧化物,所以可以用酸性高锰酸钾溶液或碱液等。
(3)没有及时关闭活塞A,则通过的气体就偏多,测定结果就偏低。
乙.(4)双氧水具有氧化性,可以把SO2氧化生成硫酸,而双氧水被还原生成水。所以在反应②就是硫酸和氢氧化钡的中和反应。
(5)沉淀应该在过滤器中进行,具体操作是向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次。
(6)硫酸钡是mg,则根据硫原子守恒可知SO2的物质的量是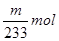 。所以SO2的体积分数是
。所以SO2的体积分数是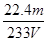
丙.(7)由于SO2和氢氧化钡反应生成的亚硫酸钡易被氧化生成硫酸钡,因此最后得到的固体是混合物,所以方案是不正确的。
本题难度:一般