1、选择题 向KI溶液中加入AgNO3溶液,直到反应恰好完全为止,结果反应后溶液的质量恰好等于原KI溶液的质量,则该AgNO3溶液中溶质的质量分数为(? )
A.50.0%
B.48.8%
C.38.2%
D.72.3%
参考答案:D
本题解析:这是一道没有数据的计算题。根据题意可推知AgNO3溶液的质量等于生成AgI沉淀的质量。又AgNO3—AgI↓,则AgNO3溶液中溶质的质量分数为:
w(AgNO3)= ×100%=72.3%。
×100%=72.3%。
本题难度:简单
2、实验题 在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
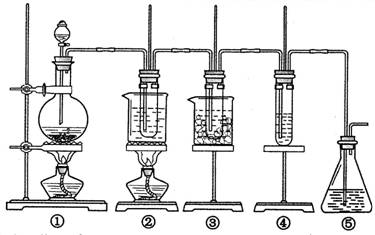
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为?。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:?
A.NaBiO3? B.FeCl3? C.PbO2?
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①?;②?。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是?(填写编号字母);从②的试管中分离出该晶体的方法是?(填写实验操作名称)。
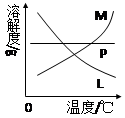
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性?。为什么??。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量??。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O?(2)A、C?
MnCl2+Cl2↑+2H2O?(2)A、C?
(3)①制取温度不同;? ②制取时碱的浓度也不同?(4)M?过滤
(5)不可,石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2?(6)0. 250mol
本题解析:(1)实验室制氯气的反应为MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)根据氧化性的强弱可知比MnO2氧化性强的NaBiO3和PbO2都可以制氯气。
(3)比较②③两个装置中所装药品可知,制取氯酸钾和次氯酸钠的差别是:制取温度不同,制取时碱的浓度也不同。
(4)溶解度随温度变化较大的物质冷却后有晶体析出,所以M符合。分离的方法是过滤。
(5)氯气褪色,是因为氯水中的HClO有强氧化性和漂白性,所以不能证明氯气有强氧化性。
(6)100mL 3.00mol/L的NaOH溶液恰好完全反应,根据原子守恒,说明溶液中n(Cl-)+n(ClO-)=0.3mol。又知溶液中n(ClO-)=0.05mol,所以n(Cl-)=0.25mol。
点评:本实验题难度较大,综合性较强,有利于对学生解题思维的锻炼。
本题难度:一般
3、选择题 以下四种物质都有漂白性,其中符合下列条件的是
①本品为无色液体呈碱性;,②使用时应加水稀释;③可对餐具进行消毒。
A.C12
B.SO2
C.H2O2
D.NaC1O
参考答案:D
本题解析:A.C12不符合条件①,因为氯水是浅黄绿色的液体。
B.SO2不符合条件①,因为其水溶液呈酸性,不呈碱性。
C.H2O2不符合条件①,其水溶液呈中性。
D.NaC1O都符合以上三个条件,故选D。
本题难度:简单
4、选择题 下列反应中,光照对反应几乎没有影响的是
[? ]
A.氯气与氢气的反应
B.氯气与甲烷的反应
C.氧气与甲烷的反应
D.次氯酸的分解
参考答案:C
本题解析:
本题难度:简单
5、选择题 Cl2可用来消灭田鼠,使用时可将Cl2通过管子灌入洞中,这是利用Cl2下列性质中的?
[? ]
A.黄绿色
B.密度比空气大
C.有毒
D.较易液化
参考答案:BC
本题解析:
本题难度:简单