1、填空题 下列微粒之间,属于同位素的是?;属于同素异形体的是?;
属于同分异构体的是?;固体时属于同种晶体类型的是?。
A.正丁烷与异丁烷、 B.红磷与白磷、C.氕与氚、 D.氯化钠与干冰、 E.金刚石与水晶、F.氧气和臭氧、G. 13C和14C、H.CH3CH(CH3)CH2CH(CH3)CH3和CH3C(CH3)2CH2CH2CH3。
参考答案:CG;BF;AH;ABEFH
本题解析:同位素是指质子数相同,中子数不同的同一种元素的不同核素互称为同位素,分子式相同结构不同的化合物互为同分异构体,由同一种元素形成的不同单质互为同素异形体。所以互为同位素的是CG,互为同素异形体的是BF,互为同分异构体的是AH,ABEFH都是分子晶体。
本题难度:一般
2、填空题 (8分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
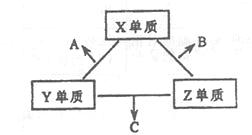
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是?。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在?。
(3)①C在一定条件下反应生成A的化学方程式是?。
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH<7,其原因是(写出离子方程式)?。
参考答案:

本题解析:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),且一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,则X、Y、Z分别为O、N、H,A、B、C分别为NO、H2O、NH3,由于H2O、NH3分子中存在氢键,使它们的沸点反常,W为硝酸与NH3反应生成NH4NO3,NH4+水解显酸性, NH4++H2O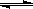 NH3?H2O+H+.
NH3?H2O+H+.
本题难度:一般
3、填空题 W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素;Z元素的最高正化合价为+6。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为?,X为?,Y为?,Z为?;
(2)Y2Z是由?键组成的物质,其电子式为?;
(3)由Y、X、W组成的物质中有?键和?键,形成的是?化合物;
(4)用电子式表示Z与钙形成化合物的过程?。
参考答案:(1) H? O? Na? S?(2)离子键?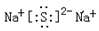 (3)离子?共价?离子?(4)?
(3)离子?共价?离子?(4)?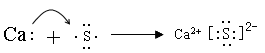
本题解析:Z元素的最高正化合价为+6,所以Z是硫元素。Y和W的最外层电子数相等,因此Y和W属于同一主族。因为只有Y为金属元素,所以Y如果是镁,则W是Be,不正确。如果Y是Al,则W是B。则不能满足Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。所以Y只能是钠,W是氢元素,X是氧元素。钠和硫分别是活泼的金属和活泼的非金属,形成的化学键是离子键。由H、O、Na形成的化合物是氢氧化钠,含有离子键和极性键,属于离子化合物。钙是活泼的金属元素,所以和硫形成的化合物硫化钙是由离子键形成的离子化合物。
本题难度:一般
4、选择题 A、B是短周期第ⅦA族元素,元素A的非金属性比B强,下列说法正确的
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1mol HA分子中H-A键断裂时吸收的能量比1mol HB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
参考答案:A
本题解析:由题意可知A为F元素,B为CL元素;所以
A正确,NaF、NaCL晶体均为离子晶体;B错,将F2通入NaBr溶液中反应的方程式为:
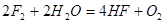 ;C错,HA比HB沸点高的原因是:HF分子间存在氢键;D错,NaF为强碱弱酸盐,溶液显碱性,NaCL为强酸强碱盐,溶液显中性;
;C错,HA比HB沸点高的原因是:HF分子间存在氢键;D错,NaF为强碱弱酸盐,溶液显碱性,NaCL为强酸强碱盐,溶液显中性;
本题难度:一般
5、推断题 X、Y、Z、T、W五种元素的性质或原子结构如下表:
元素
| 元素性质或原子结构
|
X
| 原子的最外层电子数是次外层电子数的2倍
|
Y
| 常温下单质为双原子分子,其氢化物的水溶液呈碱性
|
Z
| 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2
|
T
| 与Z同周期,元素最高价是+7价
|
W
| 原子序数为Y、T元素之和,不锈钢中含有该元素
|
?
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如下图所示:
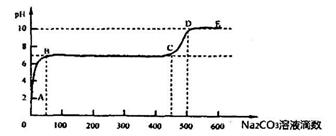
请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
参考答案:
(1)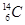 或14C (1分)? 1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
或14C (1分)? 1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
(2)Cl (1分)? B、D(2分)
(3)1:1(或答1)(1分)?分子晶体(1分)? Y的氢化物(氨)分子间存在氢键作用(1分)
(4)①CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H2O(l)?ΔH=-10aKJ/mol(2分)
②Ca2++ CO32-=CaCO3↓(2分)
CO32-+H2O  ?HCO3-+OH-(2分)
?HCO3-+OH-(2分)
本题解析:根据题意可知X、Y、Z、T、W分别为C、N、S、Cl、Cr;
(1)14C常用来测定文物年代,Cr的基态原子电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)S和Cl相比非金属性较强的Cl,选项中A、C不能作为判断非金属性强弱的依据,而B、D中氢化物的稳定性、电负性可以作为判断依据;
(3)CS2分子中含有2个σ键与2个π键,个数比为1:1,属分子晶体,N的常见氢化物(如氨气)易液化的主要是因为分子间存在氢键;
(4)生成0.1mol二氧化碳放出aKJ的热量,故反应热为-10aKJ/mol;开始溶液中有过量的算,滴加碳酸钠,发生反应,pH升高,后来钙离子与碳酸根结合生成碳酸钙沉淀,钙离子反应完后,再加入碳酸根,发生水解,pH升高。
本题难度:一般