1、选择题 下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
参考答案:B
本题解析:位于金属和非金属分界线附近的元素往往能既表现金属性,又表现非金属性,A不正确。C不正确,例如氢离子等。D不正确,同主族元素最外层电子数相同,化学性质相似,而不能完全相同。主族元素的最高价一般等于主族序数,所以正确的答案是B。
本题难度:一般
2、选择题 下列有关元素周期表的说法中错误的是

A.氢处 于第一周期
于第一周期
B.氯处于VⅡA族

C.第二周期共有8种元素
D.第三周期元素全部是金属
参考答案:D
本题解析:略
本题难度:一般
3、填空题 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______(写化学式),
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为________________________________________________________________________。
参考答案:(10分) (1)第二周期第ⅥA族(2)HClO4 (3)Cl2、ClO2、O3(任写两种)
(4)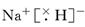 NaH+H2O=NaOH+H2↑
NaH+H2O=NaOH+H2↑
本题解析:X、Z同主族,可形成离子化合物ZX,这说明两种元素越大是第IA族元素,其中X是氢元素。Y、M同主族,可形成MY2、MY3两种分子,则Y是氧元素,M是S元素,因此Z是Na元素,G是氯元素。
(1)氧元素第原子序数是8,则位于周期表的第二周期第ⅥA族。
(2)非金属性越强,最高价氧化物对应水化物的酸性越强,氯元素的非金属性最强,则最高价氧化物对应的水化物酸性最强的是HClO4。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、ClO2、O3等。
(4)氢化钠是含有离子键的离子化合物,电子式是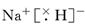 。氢化钠和水反应生成氢气和氢氧化钠,则反应的化学方程式是NaH+H2O=NaOH+H2↑。
。氢化钠和水反应生成氢气和氢氧化钠,则反应的化学方程式是NaH+H2O=NaOH+H2↑。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、选择题 据报道,放射性同位素钬(16667Ho)可有效地治疗肝癌,该同位素原子的核内中子数与核外电子数之差是
A.166
B.67
C.99
D.32
参考答案:D
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,核外电子数等于质子数,所以该同位素原子的核内中子数与核外电子数之差是166-67-67=32,答案选D。
本题难度:一般
5、选择题 下列物质性质的比较中正确的是
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
参考答案:B
本题解析:考查元素周期律的应用。只有同主族元素中第ⅠA族元素的金属性比第ⅡA族元素的金属性强,A不正确。F的非金属性最强,所以氟化氢中存在氢键,沸点最高,B正确。同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强,C不正确。第三周期元素的阳离子半径逐渐减小,阴离子半径也是逐渐解析的。但阴离子大于阳离子半径,所以选项D也是错误的。答案选B。
本题难度:简单