|
|
|
高考化学知识点总结《热化学方程式》高频试题预测(2019年最新版)(八)
2019-05-30 02:41:59
【 大 中 小】
|
1、选择题 单斜硫和正交硫是硫的两种同素异形体。 已知:
①S(s,单斜)+O2(g)=SO2(g) △H1=-297.16kJ/mol
②S(s,正交)+O2(g)=SO2(g) △H2=-296.83kJ/mol
下列说法正确的是
[? ]
A.S(s,单斜)=S(s,正交) △H3=+0. 33kJ/mol
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂1mol O2中的共价键所吸收的能量比形成1molSO2中的共价键所放出的能量多297. 16kJ
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ/mol
B.+44.2kJ/mol
C.-330kJ/mol
D.+330kJ/mol
|
参考答案:A
本题解析:已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-411.0kJ/mol和-1366.8kJ/mol,因此有热化学方程式①H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol,②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g)△H=-1366.8kJ/mo,则根据盖斯定律可知,②-③即可得到C2H4(g)+H2O(l)=C2H5OH(l),所以反应热△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,答案选A。
考点:考查反应热的有关计算
本题难度:一般
3、简答题 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家.
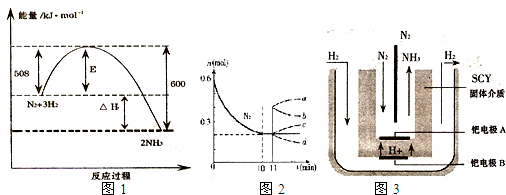
(1)如图1表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
①写出氮气与氢气合成氨的热化学反应方程式:______
②对于合成氨的反应下列说法正确的是______(填编号)
A、该反应在任意条件下都可以自发进行
B、加入催化剂,能使该反应的E和△H都减小
C、若反应在298K、398K时的化学平衡常数分别为K1、K2,K1>K2
D、该反应属于人工固氮
(2)现在普遍应用的工业合成氮的方法N2+3H2?2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高.
①能使该反应的反应速率增大,且平衡向正方向移动的措施是______(填编号)
A、使用的更高效催化剂
B、升高温度
C、及时分离出氨气
D、冲入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下、2L的密闭容器中发生N2+3H2?2NH3的反应,如图2表示N2的物质的量随时间的变化曲线.用H2表示0~10min内该反应的平速率v(H2)=______.从1min起,压缩容器的体积为1L,则n(N2)的变化曲线为______(填编号)
A、a?B、b?C、c?D、d
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通入一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图3).
请回答:铠电极是电解池的______极(填“阳“或“阴“),该极上的电极反应式是______.
参考答案:(1))①由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,
所以合成氨的热化学反应方程式为N2(g)+3H2(g)?催化剂?.?2NH3(g)△H═-92kJ/mol,
故答案为:N2(g)+3H2(g)?催化剂?.?2NH3(g)△H═-92kJ/mol;
②A、该反应为焓减熵减,△H-T△S<0,反应自发进行,故应在低温下可能自发进行,故A错误;
B、加入催化剂降低活化能,不影响反应热,故B错误;
C、该反应为放热反应,升高温度,平衡向逆反应移动,平衡常数降低,故C正确;
D、工业合成氨是人工固氮,故D正确.
故选:CD;
(2)①A、使用的更高效催化剂,反应加快,不影响平衡移动,故A错误;
B、升高温度,反应加快,平衡向吸热反应移动,即向逆反应移动,故B错误;
C、降低生成物浓度,速率降低,平衡向正反应移动,故C错误;
D、冲入氮气,增大氮气的浓度,速率加快,平衡向体积减小方向移动,即平衡向正反应移动,故D正确.
故选:D;
②由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)=0.4mol2L10min=0.02mol/(L?min),
?速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(L?min)=0.06mol/(L?min),
压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选D,
故答案为:0.06mol/(L?min);D;
(3)由图3可知,氮气在铠电极放电生成氨气,所以铠电极为阴极,在电解池中,阴极发生得电子的还原反应,氮气得电子的过程为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.
本题解析:
本题难度:一般
4、选择题 白磷与氧可发生如下反应:P4+5O2===P4O10.已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P==="O" c kJ/mol、O==="O" d kJ/mol.
根据右图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是
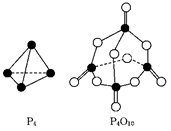
A.(4c+12b-6a-5d) kJ/mol
B.(6a+5d-4c-12b) kJ/mol
C.(4c+12b-4a-5d) kJ/mol
D.(4a+5d-4c-12b) kJ/mol
|
参考答案:B
本题解析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据物质的结构可知,该反应的反应热△H=(6a+5d-4c-12b) kJ/mol,答案选B。
本题难度:一般
5、选择题 下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+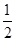 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.②
B.①②
C.①③
D.②③
参考答案:D
本题解析:碳完全燃烧放出的热量多,但放热反应中△H<0,因此放热越多△H越小,即ΔH前者大于后者,①不正确;由于气态硫的总能量高于固态硫的总能量,因此气态硫燃烧放出的热量多,则ΔH前者小于后者,②正确;生石灰溶于水是放热反应,碳酸钙分解是吸热反应,△H>0,则ΔH前者小于后者,③正确,答案选D。
考点:考查反应热的大小比较
本题难度:一般
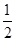 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2