1、简答题 实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含?有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
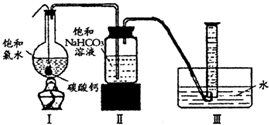
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液?B.饱和碳酸氢钠溶液?C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
明显小于.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.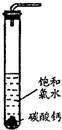
参考答案:(1)在饱和氯水中存在如下平衡:Cl2+H2O

?HClO+HCl,盐酸的酸性比碳酸强,而HClO的酸性比碳酸弱,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO,
故答案为:在饱和氯水中存在如下平衡:Cl2+H2O

?HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO;
(2)加入过量的块状碳酸钙,过量的CaCO3与溶液中的HCl发生反应,最终生成HClO,同时生成Ca(HCO3)2和CaCl2,
所以与石灰水混合,立即产生大量白色沉淀,反应的离子方程式为Ca2++HCO3-+OH-=CaC03↓+H2O,溶液中存在大量的HCO3-离子,加入盐酸,发生HCO3-+H+=CO2↑+H2O,会有大量气体生成,
故答案为:Ca2++HCO3-+OH-=CaC03↓+H2O;HCO3-+H+=CO2↑+H2O;
(3)由实验③可知,除HClO外,还生成Ca(HCO3)2和CaCl2,故答案为:HClO、Ca(HCO3)2、CaCl2;
(4)二氧化碳难溶于饱和碳酸氢钠溶液,可用排饱和碳酸氢钠溶液的方法收集二氧化碳气体,故答案为:B;
(5)碳酸氢钙不稳定,加热生成碳酸钙和二氧化碳,导致生成的二氧化碳的物质的量小于原碳酸钙的物质的量,
故答案为:碳酸钙与氯水反应生成的?Ca(HC03)2?再受热时,除生成?CO2?外,还生成了?CaC03.
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是?

[? ]
A.浓硫酸的装运包装箱应贴上如图所示的标识
B.用25ml酸式滴定管量取20.00ml 0.01?mol/L的Na2CO3溶液
C.能使湿润的淀粉-碘化钾试纸变蓝的气体一定是Cl2
D.从含I-的溶液中提取碘可以先加入稀硫酸与3%的H2O2溶液,再用酒精萃取
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列关于氯水的叙述中,正确的是
A.新制的氯水盛放在棕色瓶中,放置于阴凉处
B.新制的氯水中含有氯气分子,氯分子可以杀菌、消毒
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性减弱
参考答案:A
本题解析:略
本题难度:一般
4、简答题 (1)新制备的氯水中存在许多微粒,氯水呈黄绿色,说明氯水中含有______(填分子式),若加入Na2CO3会有大量无色气体产生,说明氯水中含有______(填离子符号),若加入AgNO3溶液,会有白色沉淀产生,说明氯水中含有______(填离子符号),若滴入蓝色墨水,墨水会褪色,说明氯水中含有______(填分子式)
(2)写出下列仪器的名称
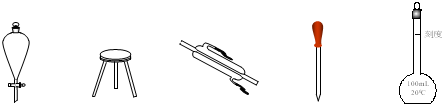
①______?②______?③______?④______?⑤______.
参考答案:(1)氯气微溶于水,水中因溶解少量氯气而呈黄绿色,氯气与水反应:Cl2+H2O=H++Cl-+HClO,溶液呈酸性,加入Na2CO3会有大量无色气体产生,加入AgNO3溶液,会有白色沉淀产生,HClO具有强氧化性和漂白性,滴入蓝色墨水,墨水会褪色,
故答案为:Cl2;H+;Cl-;HClO;
(2)①为分液漏斗;②为三角架;③为冷凝管;④为胶头滴管;⑤为容量瓶.
故答案为:分液漏斗;三角架;冷凝管;胶头滴管;容量瓶.
本题解析:
本题难度:一般
5、填空题 (1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl="2KCl" +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
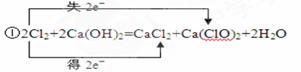
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况?。
②漂白粉的有效成分是(填化学式)?。
参考答案:(1)2:3; 1:1; 2:3
(2)还原性 酸性 14.2克; 2.408×1023
(3)

本题解析:略
本题难度:简单