1、选择题 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越
来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4  MgxMo3S4;在镁原电池放电时,下列说法错误的是
MgxMo3S4;在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移
B.正极反应为:Mo3S4+2xe-=Mo3S42x-
C.Mo3S4发生氧化反应
D.负极反应为:xMg-2xe-=xMg2+
参考答案:C
本题解析:该氧化还原反应中,Mg是还原剂,被氧化,Mo3S4是氧化剂,被还原,发生还原反应。故C错误。
本题难度:一般
2、填空题 (18分)C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径
| 还原性
| 得电子能力
|
N3- Al3+
| O2- S2-
| 35Cl 37Cl
|
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
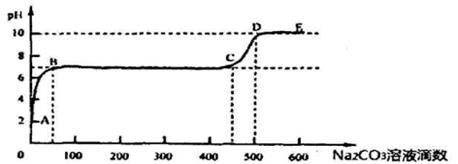

请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
参考答案:(1)二 、IVA 、 14C (每空1分,共3分)
(2)大于 小于 等于(每空1分,共3分)
(3)①CaCO3(s)+ 2HCl(aq)= CaCl2(aq)+ H2O(l) +CO2(g)?H =" -10a" kJ/mol (2分)
②Ca2++ CO32-= CaCO3↓(2分)
(4)H2-2e-+2OH- = 2H2O(2分)
本题解析:(1)C元素位于元素周期表第二周期,IVA族,常用14C测定文物年代,这种同位素的符号为14C;
(2)N3-与 Al3+的电子层结构相同,则原子序数小的离子半径大,所以离子半径:N3-大于Al3+;O的氧化性大于S,则O2-的还原性小于S2-;35Cl与 37Cl都是Cl元素的不同原子,化学性质相似,所以得电子能力相同;
(3)①CaCO3和适量HCl溶液反应时生成二氧化碳气体,氯化钙、水,所以4.4g二氧化碳的物质的量是4.4g/44g/mol=0.1mol,则1mol碳酸钙与适量HCl溶液反应放出的热量是10akJ,则该反应的热化学方程式为CaCO3(s)+ 2HCl(aq)= CaCl2(aq)+ H2O(l) +CO2(g)?H =" -10a" kJ/mol;
②因为二氧化碳能溶于水,使氯化钙溶液显酸性,所以开始加入的碳酸钠与溶解的二氧化碳反应,BC段的pH保持不变,说明此时加入的碳酸钠与氯化钙反应生成碳酸钙沉淀,离子方程式为Ca2++ CO32-= CaCO3↓;
(4)氢氧燃料电池中负极发生氧化反应,所以在负极发生反应的是氢气,电解质溶液是氢氧化钠,则氢气失去电子,与电解质溶液中的氢氧根离子结合为水,所以负极的电极反应式为H2-2e-+2OH- = 2H2O。
考点:考查元素位置的判断,离子半径、还原性的判断,热化学方程式的书写,原电池电极反应式的书写
本题难度:困难
3、实验题 有A、B、C三块金属浸泡在稀硫酸中,用导线两两相连要以组成各种原电池。若A、B相连,A为负极;B、C相连,B上有气泡逸出;A、C相连,A极减轻。则三种金属的活动性顺序由大到小排列为?。
参考答案:A>C>B
本题解析:本题能力层次为C。金属组成原电池时,相对活拨的金属失去电子作负极,被氧化,质量减轻,相对不活泼的金属作正极,发生还原反应,有物质析出,由题意得金属活动关系为:A>B、C>B、 A>C,综合分析金属活动性关系为A>C>B。答案:A>C>B
学法指导:本题主要考查原电池原理的应用。通过原电池原理,比较金属活动性强弱一般是, 负极金属>正极金属。常见判断正负极反应的现象有:
负极反应或现象:①氧化反应?②电极溶解?③电子流出 ④电流流入
正极反应或现象:①还原反应?②有物质析出 ③电子流入 ④电流流出
本题难度:简单
4、选择题 已知可逆反应AsO43-+2I-+2H+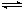 AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是
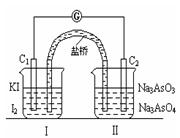
A.①操作过程中C1棒上发生的反应为2I--2e-=I2
B.②操作过程中导线上电子定向移动方向由C2→C1
C.若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气
D.若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极
参考答案:C
本题解析:①操作过程中C1棒是负极,A正确。加入氢氧化钠平衡向逆反应方向移动,所以C2棒是负极,B正确。C2棒是负极,与之相连的电极是阴极,铝离子放电,所以C是错误的。①操作过程中C1棒是负极,与之相连的电极是阴极,因此D正确。答案选C。
本题难度:一般
5、选择题 某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
[? ]
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为C,负极为Fe,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为CuSO4
参考答案:D
本题解析:
本题难度:一般