| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《水的电离平衡》高频考点强化练习(2019年最新版)(六)
参考答案:A 本题解析:A、c( H+)>c(OH-)的溶液一定显酸性,符合溶液酸碱性的判断,正确;B、常温下,pH=6的溶液为酸性溶液,但不一定是酸溶液,可能是强酸弱碱盐溶液,错误;C、电解稀硫酸或氢氧化钠溶液的实质都是电解水,产物都是氢气和氧气,错误;D、将纯水加热,水的电离平衡正向移动,氢离子和氢氧根离子浓度都增大,水的离子积增大,但pH减小,错误,答案选A。 本题难度:一般 2、选择题 在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 |
参考答案:A
本题解析:甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,因为盐酸为强酸,而醋酸为弱势,所以两种溶液中醋酸的浓度比较大,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,说明了反应的Zn的质量是想等的,说明加入盐酸的Zn的质量比较大,故A正确,C错误,D也错误,因为醋酸在反应中电离出氢离子,所以乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大,B也错误,若甲烧杯中的酸过量,则得不到相同质量的氢气。故答案为A。
考点:强弱酸
点评:本题考查了强弱酸的反应的相关计算,本题比较抽象,难度较大。
本题难度:简单
3、填空题 (8分)(1)剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。此反应的化学方程式为: 。
(2)人的纯净胃液是一种无色液体,呈酸性,pH在0.9~1.5之间, 其中H+ 的浓度比血液中高几万倍,回答下列问题:
①胃液有帮助人体消化食物等多种功能,胃酸的主要成分是 。
②若胃酸酸度增高就会患胃酸过多症,下列物不宜用做治疗胃酸过多的药物是( )
A.小苏打粉
B.氢氧化铝 粉
粉
C.氧化钙粉末
D.纯碳酸钙粉
③胃舒平主要成分是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的化学方程式: 。
参考答案:
本题解析:略
本题难度:一般
4、填空题 (10分)
(一)双氧水和水都可看成是极弱的电解质,但H2O2与H2O相比,H2O2显弱酸性。
(1)若把H2O2看成二元弱酸,试写出它在水中的电离方程式 。
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为 。
(二)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
参考答案:
本题解析:
本题难度:一般
5、实验题 (14分)I.如下图所示,50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在装置中进行中
和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题: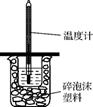
(1)图中装置缺少的仪器是 。
(2)下列说法不正确的是 (填序号)。
A.若用50mL0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______________,直至滴定终点。判断到达终点的现象是__________________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL则c(HCl)= 。
(4)下列操作中,可能造成测定结果偏高的是 。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
参考答案:I.(1)环形玻璃搅拌棒 (2)BC II.(1)BDCEAF 或ABDCEF (2)锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。 (3)0.075mol/L (4)AD
本题解析:
试题解析:I.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;(2)醋酸是弱电解质,电离要吸热,测得的中和热数据会偏小,故B应选;硫酸雨氢氧化钡反应,除生成水外还生成硫酸钡,放出热量增多,使中和热数据偏大,故C应选;II.(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF;(2)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;(3)16.80 mL与其它数据差别过大,舍去,则V(NaOH)(平均消耗)==1/2(14.98 +15.02)mL=15.00mL,c(HCl)=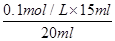 =0.075mol/L;(4)未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=
=0.075mol/L;(4)未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=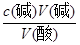 ,可知c(酸)偏高,故A正确;滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=
,可知c(酸)偏高,故A正确;滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=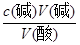 ,可知c(酸)偏小,故B错误;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=
,可知c(酸)偏小,故B错误;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=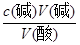 ,可知c(酸)不变,故C错误;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=
,可知c(酸)不变,故C错误;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=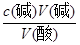 ,可知c(酸)偏高,故D正确。
,可知c(酸)偏高,故D正确。
考点:酸碱中和滴定
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《原电池原理.. | |