1、填空题 (8分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_______ __ ___。
(2)若溶液M由10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合而得,
则溶液M的pH_ __7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_ _ __。
(3)若溶液M有下列三种情况:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,
则三种情况的溶液中H2A分子浓度最大的为______;pH由大到小的顺序为______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于、等于、小于”或“均有可能”)。
参考答案:(8分)
(1)H2A H++HA- ,HA-
H++HA- ,HA- H++A2-(2分)
H++A2-(2分)
(2)>(1分),c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) (2分)
(3)③(1分), ②>③>① (1分),
(4)均有可能(1分)
本题解析:(1)因为该溶液中存在H2A分子、HA-、A2-,说明该酸是弱酸,所以电离方程式为H2A H++HA- ,HA-
H++HA- ,HA- H++A2-;
H++A2-;
(2)10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合,生成Na2A,因为A2-的水解会使溶液呈碱性,A2-+H2O HA-+OH-,所以混合后的溶液pH>7,溶液存在的离子是Na+、HA-、A2-、H+、OH-,不水解的离子大于水解离子的浓度,所以离子浓度的大小关系是c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
HA-+OH-,所以混合后的溶液pH>7,溶液存在的离子是Na+、HA-、A2-、H+、OH-,不水解的离子大于水解离子的浓度,所以离子浓度的大小关系是c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
(3)①②相比,②中的HA-水解才得到H2A,所以①中的H2A浓度大;③混合后的溶液是0.01 mol·L-1的H2A与0.01 mol·L-1的NaHA溶液的混合液,因为NaHA的存在,使H2A的电离受到抑制,所以③中H2A的浓度大于①,则③的溶液中H2A分子浓度最大;①③溶液呈酸性,且③中的H2A的电离受到抑制,所以①溶液的酸性强,pH小;②的溶液呈碱性,所以三种溶液的pH由大到小的顺序是②>③>①;
(4)混合溶液c(H+)/c(OH-)=104,则c(H+)=10-5mol/L,说明混合后的溶液呈酸性,因为H2A为弱酸,pH=3H2A溶液与pH=11的NaOH溶液相比,氢离子浓度与氢氧根离子浓度相等,则酸的浓度大于碱的浓度,等体积或酸的体积大或者酸的体积小,但酸的物质的量多时,混合后的溶液都会呈酸性,所以不能确定V1与V2的大小关系。
考点:考查酸碱混合的计算,溶液中离子浓度的比较,溶液pH的判断
本题难度:困难
2、计算题 (1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH= ;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH= 。
参考答案:(1) 1 13 (2) 8
本题解析:(1)0.05mol/LH2SO4溶液中氢离子浓度为0.1mol/L,pH=1;25℃时0.05mol/LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,氢离子浓度为10-13mol/L,pH=13。
(2)100℃时,0.001 mol/L的NaOH溶液中氢氧根离子浓度为0.001mol/L,稀释到1L,氢氧根离子浓度为0.0001mol/L,氢离子浓度为 mol/L =10-8mol/L,pH=8。
mol/L =10-8mol/L,pH=8。
考点:pH计算
点评:计算碱溶液pH时利用c(H+)= 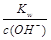 ,再求pH。
,再求pH。
本题难度:一般
3、选择题 室温时,把10 mL pH=10的强碱溶液小心地加入到10 mL pH=4的某酸溶液中,在完全反应后的溶液中滴入紫色的石蕊试液时,溶液显红色,则此酸为 ( )
A.一元强酸
B.二元强酸
C.任何强酸
D.弱酸